Espacio virtual creado para discutir casos clínicos, actualizar temas y comentar inquietudes relacionadas con la práctica de la Medicina Interna
martes, 3 de marzo de 2009
Contra viento y marea.
Una mujer de 58 años fue internada debido a dolor torácico. La noche antes del ingreso, la paciente se despertó con un dolor torácico de severa intensidad, aplastante, no pleurítico que se irradiaba hacia el brazo izquierdo, asociado a estado presincopal y diaforesis. El dolor era igual a otro experimentado antes por la paciente. No tenía disnea, fiebre, escalofrios o tos. Ella tenía hipertensión arterial de larga data, y diabetes mellitus asociada a terapia corticosteroidea por púrpura trombocitopénica autoinmune, así como historia familiar de enfermedad coronaria prematura. Ella había tenido 2 embarazos normales y 1 aborto espontáneo. Cinco meses antes de esta internación, había tenido otra internación por dolor torácico. Se hizo en esa oportunidad el diagnóstico de infarto agudo de miocardio en base a cambios electrocardiográficos y CPK elevada. La cateterización cardíaca reveló en esa oportunidad, oclusión total de la arteria descendente anterior izquierda, que fue tratada con angioplastia y colocación de stent. Esa internación estuvo complicada por una dehiscencia de la herida de la zona inguinal izquierda donde se había realizado el cateterismo, y por una infección urinaria por Escherichia coli, por lo que debió estar confinada a la cama por 10 semanas.
La historia es sugestiva de isquemia miocárdica . El dolor es como el que previamente estuvo asociado a infarto de miocardio. Un nuevo infarto de miocardio, o una angina inestable por oclusión del stent es una posibilidad muy probable, debido a que alrededor de 30% de los vasos ocluidos tratados con angioplastia se reocluyen dentro de los 6 meses. El síndrome de Dressler, o pericarditis post infarto puede presentarse con este tipo de dolor, aunque el uso de corticosteroides por la paciente y la ausencia de síntomas sistémicos hacen a este diagnóstico menos probable. La disección aórtica puede también mimetizar al infarto agudo de miocardio, y debe ser considerado en un paciente con hipertensión y enfermedad vascular. El confinamiento en cama aumenta el riesgo de embolismo pulmonar, pero la paciente no tiene disnea y su dolor torácico no es de tipo pleurítico. Neumotórax, neumonía, y procesos abdominales tal como pancreatitis, y úlcera perforada no son posibilidades fuertes en este caso dado los síntomas de la paciente, aunque deben ser tenidas en mente. Yo enfocaría el examen físico en la búsqueda de elementos de disección aórtica o pericarditis, debido a que el manejo de estos trastornos difiere sustancialmente de el manejo del infarto de miocardio. Quisiera ver una Rx de tórax y un electrocardiograma.
En el examen, la paciente tenía un aspecto cushingoide; no estaba en distress agudo. Su tensión arterial era de 120/70 mmHg en ambos brazos, su pulso de 80 por minuto, regular, su frecuencia respiratoria de 16 por minuto, y su temperatura de 36,4º C. Ella tenía numerosas petequias en la boca, una ampolla hemorrágica en la lengua, y xantelasmas bilaterales. No había ingurgitación yugular ni soplos carotídeos, y la auscultación cardíaca y pulmonar era normal. No había frotes ni soplos de regurgitación aórtica. El abdomen estaba blando, indoloro sin masas pulsátiles. Había una cicatriz de esplenectomía. Había una úlcera de decúbito grado I en sacro y una herida en región inguinalizquierda con buen lecho de granulación. Numerosas equímosis estaban presentes en las cuatro extremidades. Los pulsos eran iguales y simétricos en las cuatro extremidades. Un electrocardiograma mostró ritmo sinusal y secuela necrótica que no presentaba cambios con respecto al electrocardiograma post infarto de meses atrás. Una Rx de tórax mostró pulmones claros sin ensanchamiento mediastínico.
La disección aórtica es poco probable pero no puede ser descartada por una Rx de tórax normal, pulsos simétricos y ausencia de regurgitación aórtica en el examen físico. Aunque la historia es sugestiva de isquemia miocárdica recurrente, no hay evidencias electrocardiográficas ni de laboratorio de síndrome coronario inestable, a menos que el paciente tenga isquemia silente. Mi índice de sospecha para isquemia permanece alto. Yo comenzaría con betabloqueantes, pero no daría aspirina ni heparina por su púrpura trombocitopénica autoinmune activa, con riesgo de sangrado.
Los valores de las enzimas cardiacas, electrolitos, función renal, función hepática, tiempo de protrombina, y KPTT eran normales. El recuento de glóbulos blancos era de 7900 por mm3, el hematocrito 33,7%, y el recuento de plaquetas de 24000/mm3 (durante el tratamiento con 4 mg de dexametasona /día tiene valores habitualmente de 60000/mm3). Los gases en sangre mientras el paciente recibía 4 litros de oxígeno eran: pH 7,50, pCO2 38 mmHg, pO2 89 mmHg.
El elevado gradiente alvéolo arterial aumenta la probabilidad de embolismo pulmonar, aún en ausencia de dolor pleurítico, disnea, y taquicardia. Yo obtendría un centelleograma pulmonar inmediatamente.Debido a que la paciente tiene sangrado activo y trombocitopenia, yo no lo trataría con anticoagulantes hasta que esté convencido de que padece embolismo pulmonar.
El centelleograma de ventilación perfusión mostró un único defecto de perfusión en el lóbulo superior izquierdo sin defecto de la ventilación. El hallazgo fue interpretado como de “probabilidad intermedia” de embolismo pulmonar. El eco Doppler duplex color de extremidades inferiores fue normal. Se comenzó tratamiento con heparina endovenosa. El recuento de plaquetas obtenido 6 horas más tarde fue de 4000/mm3, y el paciente tuvo epistaxis y empeoramiento de las equímosis en sus extremidades. El cultivo de orina y dos muestras de hemocultivos fueron positivos para E coli, y se comenzó tratamiento con antibióticos.
Su infección ha probablemente empeorado la trombocitopenia y desencadenado el sangrado, y ahora hay riesgo de hemorragia catastrófica. Debido al alto riesgo de sangrado, yo estoy muy preocupado por la administración de heparina. El centelleograma pulmonar indicando probabilidad intermedia de embolismo pulmonar tiene una moderada tasa de falsos positivos, y en vista de los hallazgosnormales del estudio con Doppler venoso de miembros inferiores, creo que sería esencial obtener un angiograma pulmonar (hoy podría ser indicada una angiotomografía pulmonar previa a la angiografía). No se debe olvidar que los trombos pueden formarse a pesar de severa trombocitopenia. Yo también lo trataría con gamaglobulina intravenosa por la trombocitopenia.
Se llevó a cabo una angiografía pulmonar sin complicaciones, y un coágulo en el segmento anterior del lóbulo superior izquierdo fue encontrado. Otros resultados de laboratorio obtenidos antes de iniciar la terapia con heparina incluyeron un tiempo del veneno de Russell (para investigación de anticoagulante lúpico) de 37,3 seg (normal 21,4 a 36,2) y un test de IgG anticardiolipina positivo. Los resultados de tests para proteína C proteína S, y antitrombina III fueron normales; Un test para HIV y para mutación para factor V de Leiden fue negativo. Una revisión de sus otras internaciones en otro hospital, sin embargo, reveló una historia de trombosis venosa profunda el año previo. El tratamiento con warfarina resultó en anticoagulación sin ulterior sangrado, y la heparina fue discontinuada. Varios días después de la iniciación del tratamiento con globulina inmune intravenosa y antibióticos, su recuento plaquetario aumentó a más de 200000/mm3, y no volvió a tener nuevos episodios de sangrado ni de hemorragia.
Comentario:
El tromboembolismo pulmonar da cuenta de más de 250000 hospitalizaciones y 50000 muertes cada año en los EE UU. (1) Solo un tercio de las embolias confirmadas en autopsias son diagnosticadas antes de la muerte, (2,3) reflejando la dificultad de establecer el diagnóstico. Desde la década de 1960, no ha habido una reducción en la mortalidad por embolismo de pulmón, (4) a pesar de un amplio uso del centelleograma y la angiografía. (5,6) La experiencia con esta paciente, pone en evidencia la importancia de un alto índice de sospecha clínica y un approach racional de testeo.
La paciente se presentó con dolor torácico que era similar a un infarto previo en un contexto de confinamiento en cama por púrpura trombocitopénica autoinmune. El índice de sospecha para isquemia miocárdica recurrente fue alto debido a que 30% de los vasos coronarios se reocluyen dentro de los 6 meses de la angioplastía. (7) Aún así, el médico que analizó el caso formuló un diagnóstico diferencial que incluyó procesos vasculares, pericárdicos, pulmonares y gastrointestinales. La evaluación inicial se focalizó en los signos de disección aórtica y pericarditis, ya que los approaches iniciales para el tratamiento de infarto agudo de miocardio (anticoagulación, trombolisis, angioplastía) podrían ser peligrosas en presencia de esos trastornos. Sin embargo, el médico no encontró evidencias de síndrome de angina inestable, disección aórtica, neumotórax, o neumonía.
Es crítico tener un alto índice de sospecha para embolia pulmonar en un paciente con inexplicado dolor torácico de reciente aparición, disnea o taquipnea. Palla y colegas (8) mostraron que la presencia de cualquiera de esos síntomas, sin una explicación obvia, indicados por el hallazgo de una Rx de tórax normal, y un ECG normal, tiene una sensibilidad de 97% y una especificidad de 24% para detectar embolismo pulmonar. Este énfasis inicial en la sensibilidad diagnóstica minimiza la posibilidad de pasar por alto el diagnóstico, ya que los criterios clínicos solos, no son confiables en establecer el diagnóstico. De hecho, la paciente no tenía ninguno de los hallazgos conocidos como específicos para embolia de pulmón, tal como dolor torácico pleurítico, (9) disnea súbita, (9) taquipnea, (10,11) hemoptisis, (12) y distensión venosa yugular. (9) En vez, hallazgos menos específicos estaban presentes, incluyendo una historia de confinamiento a la cama (reportado en 55% de los pacientes con embolismo pulmonar), dolor torácico no pleurítico (reportado en 14%), y diaforesis (reportada en 27%). (12) La Rx de tórax, que es anormal en más de 80% de los pacientes, (9) fue normal en nuestra paciente. Las anormalidades electrocardiográficas en pacientes con embolismo pulmonar, taquicardia sinusal (en 44% de los pacientes) (9) y depresión del ST (en 50%), estuvieron ambos ausentes en nuestra paciente. Manteniendo un alto índice de sospecha para embolismo pulmonar, con un énfasis inicial en la sensibilidad diagnóstica, el médico consideró el diagnóstico desde el comienzo.
Un diagnóstico definitivo de embolismo pulmonar fue establecido por evaluaciones standard (13,14). El centelleograma ventilación-perfusión, fue el paso inicial, interpretado como de probabilidad intermedia de embolismo pulmonar, pero debido a que aproximadamente el 30% de los pacientes con este tipo de resultados tienen embolia de pulmón, (5) el eco Doppler venoso de miembros inferiores fue llevado a cabo, no mostrando trombos. Hull y col (6) reportaron que los pacientes ambulatorios, clínicamente estables con embolismo pulmonar y centelleogramas pulmonares no diagnósticos, andan bien sin anticoagulación, si los tests no invasivos seriados son negativos. Sin embargo, debido a que el paciente tenía factores predisponentes (confinamiento en cama), una angiografía pulmonar (el gold standard diagnóstico) fue obtenida documentándose un trombo.
Fue apropiado exponer a un paciente con sangrado activo a los riesgos de una angiografía? Un artículo previo de “Clinical Problem-Solving” (15) examinó el daño potencial de un procedimiento invasivo y los riesgos del tratamiento empírico de cara a una situación de incertidumbre diagnóstica. Ese caso particular consideró a un paciente con síntomas y signos típicos de síndrome hipereosinofílico, al menos retrospectivamente. Numerosos tests invasivos fueron llevados a cabo para descartar cáncer antes de iniciar la terapia corticosteroidea. El autor concluyó que la certeza diagnóstica era razonablemente alta y el riesgo de terapia empírica no era considerablemente mayor que la de seguir con nuevas evaluaciones. En nuestra paciente, sin embargo, la certeza diagnóstica era baja, debido a la combinación de severa trombocitopenia, sangrado activo, y centelleograma indefinido, con un Doppler de miembros inferiores negativo, no sostenían el diagnóstico de embolismo pulmonar. Aunque un trombo puede formarse sin plaquetas, (16) el médico que discutió el caso consideró que la terapia de anticoagulación empírica poseía un riesgo inaceptable de hemorragia catastrófica. (9) Por consiguiente, el riesgo de la angiografía, aunque no menor, era justificable, debido a que proveía un diagnóstico definitivo. Hoy día la angioTAC espiralada o la angio RMN proveen alternativas no invasivas que no estaban disponibles en el momento en que se planteó el caso en cuestión.
Una vez que la angiografía confirmó la presencia de un trombo, la siguiente decisión fue si tratar a la paciente con anticoagulantes o colocar un filtro en la vena cava inferior. La primera impresión en una paciente con púrpura trombocitopénica autoinmune activa con embolismo pulmonar parece que amerita la colocación de un filtro en la vena cava inferior. Los filtros de vena cava, que ayudan a prevenir la embolia pulmonar de trombos distales a la vena cava inferior, son a menudo usados en pacientes con sangrado activo por anticoagulantes, en pacientes que tienen riesgo de sangrado por anticoagulantes, y aquellos en los que la anticoagulación falla; tales filtros son también usados para la profilaxis contra el tromboembolismo en pacientes con limitada reserva cardiopulmonar. (13,19) Aunque estos elementos como los filtros de vena cava son usados frecuentemente, hay pocos estudios de eficacia y seguridad. En un ensayo randomizado, (20) la presencia de filtros en pacientes con trombosis venosa profunda redujo la tasa de embolismo pulmonar en los primeros 12 días del tratamiento, pero no afectaron la mortalidad a los 2 años. Más aún, los filtros estuvieron asociados con una excesiva tasa de trombosis venosa profunda. Los filtros removibles, temporarios están aún bajo investigación y pueden ser una alternativa atractiva en pacientes tales como este, debido a que pueden proveer un beneficio a corto plazo de la interrupción de la vena cava sin los riesgos a largo plazo demostrados en este ensayo.
La paciente fue tratada con heparina intravenosa no fraccionada, que era la terapia standard para el tromboembolismo venoso en EE UU al momento de plantearse el caso actual. Esta práctica cambió posteriormente desde que ensayos clínicos ulteriores demostraron superioridad de las heparinas de bajo peso molecular en ensayos (21,22) y metaanálisis (23) sobre las heparinas no fraccionadas. Las heparinas de bajo peso molecular también producen anticoagulación más predecible (24) y causan menos probablemente trombocitopenia, (25) ambas, muy importantes en esta paciente. Inmediatamente después de la iniciación del tratamiento con heparina no fraccionada, la trombocitopenia empeoró, probablemente debido a la urosepsis, y no a trombocitopenia inducida por heparina, que típicamente desarrolla 5 días o más después de iniciado el tratamiento. (25) Aún si el paciente hubiera tenido una trombocitopenia inducida por heparina, la heparina de bajo peso molecular hubiese estado también contraindicada debido a la reactividad cruzada entre ambas formas. (26) Así, la terapia con heparina fue continuada para tratar el tromboembolismo venoso; se administraron inmunoglobulina intravenosa y antibióticos para combatir la púrpura trombocitopénica autoinmune y la urosepsis, las dos principales causas de trombocitopenia en la paciente.
La variable final que afectó al tratamiento de esta paciente fue la documentación de síndrome antifosfolipídico. Múltiples eventos tromboembólicos en un paciente con púrpura trombocitopénica autoinmune hicieron sospechar alguna forma de trombofilia. Las deficiencias congénitas de proteína C, proteína S, y antitrombina III, sí como la presencia de la mutación del factor V de Leiden, han estado asociados con trombofilia, pero esas anormalidades no estuvieron presentes en esta paciente. Su historia gestacional, sin embargo, era consistente con el diagnóstico de síndrome antifosfolipídico, y el elevado título de anticuerpos anticardiolipinas y la prolongación del tiempo del veneno de Russell confirmaron el diagnóstico. (27) Tanto las trombosis arteriales (28) como venosas (29) recurrentes están asociados con el síndrome antifosfolipídico, aún en presencia de severa trombocitopenia. (16) Así, los factores de riesgo protrombótico para esta paciente parecen ser el síndrome antifosfolipídico y el confinamiento en cama. La trombosis en tales pacientes es prevenida mejor con terapia con warfarina llevando el RIN a 3 o más, (28) que fue el tratamiento usado en este caso.
Que podemos aprender de este caso?
Primero, el dolor torácico en pacientes con embolismo pulmonar puede tener una presentación una presentación inusual, así que, un dolor torácico inexplicado amerita al menos la consideración de tromboembolismo.
Segundo, la angiografía pulmonar, (hoy la angio TAC) pueden ser necesarios para confirmar el diagnóstico. En esta paciente el aporte de la misma fue invalorable en la justificación de asumir el riesgo de la anticoagulación.
Tercero, la sepsis causa trombocitopenia.
Cuarto, múltiples factores de riesgo a menudo contribuyen al desarrollo de tromboembolismo venoso.
Finalmente, mejores estrategias son necesarias en el tratamiento del tromboembolismo venoso en pacientes con alto riesgo de hemorragias.
A pesar de las múltiples causas y consecuencias del compromiso hemostático, un apropiado approach diagnóstico y un criterioso juicio clínico permitió al médico que discutió el caso maniobrar navegando contra viento y marea, o más precisamente en nuestra paciente contra coágulo y sangrado.
Traducción de: Through Thick and Thin
David R. Yu, M.D., Redonda Miller, M.D., and Paul F. Bray, M.D
Volume 338:1684-1687 June 4, 1998 number 23
Clinical Problem Solving.
The New England Journal of Medicine
Fuente
From the Department of Medicine, Johns Hopkins Hospital, Baltimore.
Address reprint requests to Dr. Bray at 720 Rutland Ave., Ross 1015, Baltimore, MD 21205.
References
1) Stauffer JL. Pulmonary thromboembolism. In: Tierney LM, McPhee SJ, Papdakis MA, eds. Current medical diagnosis and management. 36th ed. Stamford, Conn.: Appleton & Lange, 1997:290-7.
2) Goldhaber SZ, Hennekens CH, Evans DA, Newton EC, Godleski JJ. Factors associated with correct antemortem diagnosis of major pulmonary embolism. Am J Med 1982;73:822-826.[Medline]
3) Bergqvist D, Lindblad B. A 30-year survey of pulmonary embolism verified at autopsy: an analysis of 1274 surgical patients. Br J Surg 1985;72:105-108.[Medline]
4) Lilienfeld DE, Chan E, Ehland J, Godbold JH, Landrigan PJ, Marsh G. Mortality from pulmonary embolism in the United States: 1962 to 1984. Chest 1990;98:1067-1072.[Abstract]
5) The PIOPED Investigators. Value of the ventilation/perfusion scan in acute pulmonary embolism: results of the Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED). JAMA 1990;263:2753-2759.[Abstract]
6) Hull RD, Raskob GE, Ginsberg JS, et al. A noninvasive strategy for the treatment of patients with suspected pulmonary embolism. Arch Intern Med 1994;154:289-297.[Abstract]
7) Sirnes PA, Golf S, Myreng Y, et al. Stenting in Chronic Coronary Occlusion (SICCO): a randomized, controlled trial of adding stent im-plantation after successful angioplasty. J Am Coll Cardiol 1996;28:1444-1451.[CrossRef][Medline]
8) Palla A, Petruzzelli S, Donnamaria V, Giuntini C. The role of suspicion in the diagnosis of pulmonary embolism. Chest 1995;107:Suppl:21S-24S. [Abstract/Full Text]
9) Manganelli D, Palla A, Donnamaria V, Giuntini C. Clinical features of pulmonary embolism: doubts and certainties. Chest 1995;107:Suppl:25S-32S. [Abstract/Full Text]
10) Stein PD, Terrin ML, Hales CA, et al. Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no pre-existing cardiac or pulmonary disease. Chest 1991;100:598-603.[Abstract]
11) Other observations related to pulmonary embolism and its study. Circulation 1973;47:Suppl II:II-86.
12) Bell WR, Simon TL, DeMets DL. The clinical features of submassive and massive pulmonary emboli. Am J Med 1977;62:355-360.[Medline]
13) ACCP Consensus Committee on Pulmonary Embolism. Opinions regarding the diagnosis and management of venous thromboembolic disease. Chest 1996;109:233-237. [Full Text]
14) Ginsberg JS. Management of venous thromboembolism. N Engl J Med 1996;335:1816-1828. [Full Text]
15) Putterman C, Ben-Chetrit E. Testing, testing, testing. . . . N Engl J Med 1995;333:1208-1211. [Full Text]
16) Goodnough LT, Saito H, Ratnoff OD. Thrombosis or myocardial infarction in congenital clotting factor abnormalities and chronic thrombocytopenias: a report of 21 patients and a review of 50 previously reported cases. Medicine (Baltimore) 1983;62:248-255.[Medline]
17) van Erkel AR, van Rossum AB, Bloem JL, Kievit J, Pattynama PM. Spiral CT angiography for suspected pulmonary embolism: a cost-effectiveness analysis. Radiology 1996;201:29-36.[Abstract]
18) Meany JFM, Weg JG, Chenevert TL, Stafford-Johnson D, Hamilton BH, Prince MR. Diagnosis of pulmonary embolism with magnetic resonance angiography. N Engl J Med 1997;336:1422-1427. [Abstract/Full Text]
19) Ballew KA, Philbrick JT, Becker DM. Vena cava filter devices. Clin Chest Med 1995;16:295-305.[Medline]
20)Decousus H, Leizorovicz A, Parent F, et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. N Engl J Med 1998;338:409-415. [Abstract/Full Text]
21) The Columbus Investigators. Low-molecular-weight heparin in the treatment of patients with venous thromboembolism. N Engl J Med 1997;337:657-662. [Abstract/Full Text]
22) Simonneau G, Sors H, Charbonnier B, et al. A comparison of low-molecular-weight heparin with unfractionated heparin for acute pulmonary embolism. N Engl J Med 1997;337:663-669. [Abstract/Full Text]
23) Siragusa S, Cosmi B, Piovella F, Hirsh J, Ginsberg JS. Low-molecular-weight heparins and unfractionated heparin in the treatment of patients with acute venous thromboembolism: results of a meta-analysis. Am J Med 1996;100:269-277.[CrossRef][Medline]
24) Handeland GF, Abildgaard U, Holm HA, Arnesen K-E. Dose adjusted heparin treatment of deep venous thrombosis: a comparison of unfractionated and low molecular weight heparin. Eur J Clin Pharmacol 1990;39:107-112.[Medline]
25) Warkentin TE, Levine MN, Hirsh J, et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. N Engl J Med 1995;332:1330-1335. [Abstract/Full Text]
26)Greinacher A, Michels I, Mueller-Eckhardt C. Heparin-associated thrombocytopenia: the antibody is not heparin specific. Thromb Haemost 1992;67:545-549.[Medline]
27)Asherson RA, Khamashta MA, Ordi-Ros J, et al. The "primary" antiphospholipid syndrome: major clinical and serological features. Medicine (Baltimore) 1989;68:366-374.[Medline]
28) Khamashta MA, Cuadrado MJ, Mujic F, Taub NA, Hunt BJ, Hughes GRV. The management of thrombosis in the antiphospholipid-antibody syndrome. N Engl J Med 1995;332:993-997. [Abstract/Full Text]
29)Ginsberg JS, Wells PS, Brill-Edwards P, et al. Antiphospholipid antibodies and venous thromboembolism. Blood 1995;86:3685-3691. [Abstract/Full Text]
domingo, 1 de marzo de 2009
Mejor diagnóstico.
Estudios de laboratorio:
* Repetición de calcio sérico en ayunas 10,9 mg/dl.
* Hormona paratiroidea intacta en plasma 86 pg/ml.
* Excreción urinaria de calcio 344 mg/24 hs.
Un estudio reciente de la densidad mineral ósea mediante absorciometría de rayos X de energía dual mostró resultados normales, con una densidad ósea de 0,9 desvíos estándar por debajo de la masa ósea pico en cuello femoral izquierdo, y 0,4 desvíos estándar por debajo de la masa ósea pico en columna lumbar.
La recomendación más apropiada en este momento es:
A) Comenzar con hidroclorotiazida 25 mg cuatro veces al día.
B) Comenzar un tratamiento con fosfatos por vía oral.
C) Derivar a la paciente para una paratiroidectomía.
D) Comenzar el tratamiento con bifosfonatos por vía oral.
E) Comenzar calcitonina nasal.
Respuesta correcta: C
Objetivo educacional: reconocer las indicaciones para la paratiroidectomía en una paciente con hiperparatiroidismo primario.
Aunque esta mujer de 63 años de edad parece relativamente asintomática por su hiperparatiroidismo leve, tiene antecedentes de nefrolitiasis, presumiblemente por cálculos de oxalato de calcio. Aunque no ha tenido un episodio de cólico renal en tres años, continúa teniendo un elevado riesgo de formación de cálculos y futuros síntomas debido a su importante hipercalciuria (>4 mg/kg por día) a pesar de la dieta de una insuficiencia renal leve, la que puede estar relacionada con su calculosis, o quizás con la enfermedad tubulointersticial inducida por calcio.
La paratiroidectomía probablemente llevará a la normalización del calcio sérico y urinario, y reducirá el riesgo de futuros cálculos en las vías urinarias. Las evidencias recientes sugieren una mejoría postquirúrgica en la densidad mineral ósea.
Aunque la hidroclorotiazida puede disminuir la excreción de calcio urinario, también puede aumentar el calcio plasmático, y está relativamente contraindicada en pacientes con hiperparatiroidismo primario.
Los fosfatos neutros por vía oral disminuyen la absorción intestinal de calcio mediante la formación de complejos intraluminales, y quizás a través de un efecto indirecto al disminuir los niveles circulantes de 1,25-dihidroxivitamina D. Sin embargo, a menos que estos agentes sean administrados en forma prudente, se puede producir un incremento significativo de los niveles plasmáticos de fósforo inorgánico. En pacientes con hipercalcemia mas pronunciada, el incremento del producto calcio-fosfato raramente llega a la calcificación de tejido metastásico. Aunque es probable que la excreción urinaria de calcio disminuya con esta terapia, es poco probable que se modifique el calcio plasmático. La terapia con fosfatos por vía oral también tienen efectos adversos tal como la diarrea.
La eficacia y seguridad del tratamiento con bifosfonatos para la terapia del hiperparatiroidismo primario todavía no son claras. Aunque se puede esperar una caída inicial en los niveles de calcio sérico los efectos a largo plazo son desconocidos. Esta paciente no requiere tratamiento con bifosfonatos para la osteoporosis. Según los resultados de la absorciometría con rayos X de energía dual, la masa ósea de esta paciente parece adecuada, lo que probablemente sea un reflejo de su terapia estrogénica.
Bibliografía:
1) Silverberg SJ, Bilezikian JP. Evaluation and management of primary hyperparathyroidism. J Clin Endocrinol Metab. 1996; 81: 2036-40
2) Strewler GJ. Indications for surgery in patients with minimally symptomatic primary hyperparathyroidism. Surg Clin North Am. 1995; 75: 439-47
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians
jueves, 26 de febrero de 2009
Infiltrados pulmonares migratorios. Síndrome de Goodpasture
 globina 6,2 g/dl). Él tenía tos seca de 1 mes de evolución, dolor torácico intermitente, progresiva disnea de esfuerzo. El paciente reportó tener ocasionalmente escalofrios y sudoración nocturna. El dijo no tener adelgazamiento ni hemoptisis. Una Rx de tórax tomada 2 semanas antes de la consulta había mostrado infiltrados pulmonares en la región inferior de ambos pulmones (Figura 1A). Después de esa Rx se le indicó un curso de moxifloxacina. El paciente era un fumador. Dos o tres años antes reportó haber estado involucrado en varios episodios de sexo homosexual no protegido con un compañero del que después supo que había tenido relaciones con otros varios compañeros sexuales en el mismo período.
globina 6,2 g/dl). Él tenía tos seca de 1 mes de evolución, dolor torácico intermitente, progresiva disnea de esfuerzo. El paciente reportó tener ocasionalmente escalofrios y sudoración nocturna. El dijo no tener adelgazamiento ni hemoptisis. Una Rx de tórax tomada 2 semanas antes de la consulta había mostrado infiltrados pulmonares en la región inferior de ambos pulmones (Figura 1A). Después de esa Rx se le indicó un curso de moxifloxacina. El paciente era un fumador. Dos o tres años antes reportó haber estado involucrado en varios episodios de sexo homosexual no protegido con un compañero del que después supo que había tenido relaciones con otros varios compañeros sexuales en el mismo período.En el examen, el paciente estaba pálido y taquicárdico. Su saturación de oxígeno era de 96% por oximetría de pulso mientras respiraba aire ambiente. Sus pulmones estaban claros a la auscultación. Los tests de laboratorio mostraron una concentración de hemoglobina de 6,2 g/dl (VCM 82fL) y reticulocitos 84 x 10 9/L. La ferritina era de 86 ug/L y la creatinina sérica de 1,1 mg/dl. Su recuento leucocitario era normal. Su LDH, bilirrubina total, RIN, y KPTT estaban dentro de límites normales. Una Rx de tórax mostró una disminución en el infiltrado del lado derecho y un aumento del lado izquierdo (Figura 1B).
Cuales son los próximos tests o procedimientos diagnósticos más apropiados?
A) TAC de tórax.
B) Análisis de orina.
C) Test de HIV
D) Broncoscopía con lavado broncoalveolar.
E) Tests para hemólisis, incluyendo test para crioaglutininas.

Todas las investigaciones mencionadas pueden ser consideradas apropiadas en este punto. En nuestro paciente, el test que condujo al diagnóstico actual fueron B y D
Después de administrarle una transfusión de sangre, con lo que el paciente se sintió mejor, fue dado de alta. Se arregló con el paciente para un seguimiento cercano como ambulatorio a la espera de nuevos síntomas, estado HIV, y nivel de hemoglobina. Se le administró azitromicina por un diagnóstico presuntivo de neumonía por micoplasma, posiblemente asociado a anemia hemolítica por síndrome de crioaglutininas, o anemia secundaria a infección por HIV. El test de HIV se recibió a la semana y fue negativo.
El paciente se presentó nuevamente 6 semanas más tarde con los mismos síntomas. En este momento el nivel de hemoglobina fue de 7,3 g/dl, la creatinina de 1,7 mg/dl, y los análisis de orina mostraron proteinuria (3+) y hematuria microscópica (5+). No había cilindros. Una Rx de tórax mostró empeoramiento de los infiltrados en ambos lados (Figura 2)
Cual es su diagnóstico?
A) Infección por pneumocistis jiroveci.
B) Síndrome de Löffler.
C) Síndrome de Goodpasture.
D) Síndrome de Churg-Strauss.
E) Neumonía criptogénica en organización.
Discusión
El diagnóstico es (C) síndrome de Goodpasture. La presencia de factores de riesgo parainfección por HIV nos condujo inicialmente a buscar una causa infecciosa. Después que HIV fue descartado, se descubrió hematuria microscópica que aumentó la posibilidad de un síndrome pulmón-riñón. El test para anticuerpos antinucleares y ANCA fueron negativos. Sin embargo, el título de anticuerpos antimembrana basal glomerular estaba elevado a 1:40. La biopsia renal mostró lesiones segmentarias y necrotizantes con formación de semilunar (Figura 3A). La tinción con inmunofluorescencia de la membrana basal glomerular fue fuertemente positiva para IgG (Figura 3B). Las lesiones histológicas como la inmunofluorescencia son hallazgos diagnósticos de síndrome de G oodpasture.
oodpasture.
Al paciente se le administró prednisona y ciclofosfamida, y se lo sometió a una serie de plasmaféresis. Después de 3 meses de terapia, los anticuerpos anti membrana basal fueron negativos.Después de 6 meses de seguimiento, el paciente está asintomático, y su creatinina sérica está en valores normales.
El síndrome de Goodpasture es raro, afecta a menos de 1 persona por millón de habitantes. (1)
Los anticuerpos dirigidos contra la membrana basal glomerular son producidos en respuesta a estímulos desconocidos y causan glomerulonefritis. En alrededor de 60% de los casos causan también hemorragia pulmonar por ataque de los anticuerpos a la membrana basal alveolar. El hábito de fumar cigarrillos aumenta el riesgo de compromiso pulmonar. (2) Los pulmones se afectan más frecuentemente en adultos jóvenes.
Los pacientes con manifestaciones pulmonares de síndrome de Goodpastura se presentan con disnea y tos. (3) La hemoptisis ocurre menos frecuentemente. Los infiltrados pulmonares son frecuentemente migratorios, y en ese contexto ocurre deficiencia de hierro.
El término “migratorio” es usado para describir infiltrados pulmonares recurrentes que aparecen y se resuelven en un corto período (días a semanas), con nuevos infiltrados que aparecen y se resuelven en cortos períodos (días o semanas), con infiltrados nuevos que aparecen en distintas zonas de los pulmones. Los infiltrados parecen así, “moverse” o “migrar” en los pulmones a través del tiempo.
Los tests de función pulmonar en pacientes con síndrome de Goodpasture muestran una elevada capacidad de difusión de monóxido de carbono. El pulmón se afecta más probablemente, si hay antecedentes de injuria parenquimatosa por factores tales como la infección, o, más frecuentemente hábito tabáquico.
Síntomas constitucionales, tales como fatiga, pérdida de peso, y fiebre son raros, y a menudo sugieren vasculitis.
El diagnóstico de síndrome de Goodpasture está basado en hallazgos de tests de anticuerpos anti membrana basal glomerular y de la biopsia renal. La biopsia muestra depósitos lineales de IgG a lo largo de la membrana basal, elemento patognomónico de este trastorno (Figura 3B). El tratamiento consiste en altas dosis de prednisona oral y ciclofosfamida en combinación con plasmaféresis. Sin embargo, hay poca evidencia disponible que sostenga este tratamiento. (4) El pronóstico a largo plazo del síndrome de Goodpasture depende del grado inicial de compromiso renal y la severidad de los hallazgos histológicos.
De este caso se pueden extraer tres enseñanzas:
Primero, la hemorragia pulmonar es una importante causa de anemia severa y debe ser considerada en el diagnóstico diferencial. La ausencia de hemoptisis no descarta hemorragia pulmonar significativa.
Segundo, aumentos relativamente pequeños en los niveles de creatinina pueden implicar una severa pérdida de la función renal. El nivel de creatinina de nuestro paciente se elevó solo mínimamente; sus síntomas pulmonares fueron mucho más prominentes. Por lo tanto no se consideró de entrada la posibilidad de síndrome pulmón-riñón. Nuestro ejemplo resalta la importancia de reconocer la relativamente pobre sensibilidad de la creatinina sérica para detectar reducciones tempranas de la tasa de filtrado glomerular en la injuria renal aguda. Los niveles de creatinina sérica cambian poco cuando la tasa de filtrado glomerular cae desde 120 ml/min a 90 ml/min. Pero aumenta significativamente con una reducción de la tasa de filtrado glomerular de 90 ml/min a 60 ml/min. Por lo tanto, los clínicos deben considerar medir directamente la filtración glomerular midiendo el clearence de creatinina cuando existe cualquier grado de incertidumbre en el valor de creatinina sérica.
Tercero, los análisis de orinadeben ser incluidos en análisis de rutina, debido a que son rápidos, baratos y a menudo informativos. Nosotros recién consideramos síndrome de pulmón-riñón en nuestro paciente, cuando nos anoticiamos de la hematuria microscópica. En suma, la hemorragia pulmonar debe ser considerada en cualquier paciente que se presenta con infiltrados pulmonares recurrentes, particularmente si tiene anemia inexplicada.
Tests diagnósticos
Consideraciones en cuanto a la selección de tests diagnósticos incluyen no solo la relevancia del resultado en descartar o confirmar una hipótesis diagnóstica (por ejemplo condiciones que ponen en riesgo la vida) sino también el costo, la facilidad, disponibilidad y velocidad en que el test puede ser realizado. Un test de HIV estuvo ciertamente indicado en este caso, pero los resultados no hubieran estado inmediatamente disponibles en este caso para su uso. Un examen de sangre periférica podría haber sido útil en estrechar el diagnóstico diferencial si la anemia del paciente fuera considerada como secundaria a hemólisis. Sin embargo, los marcadores de hemólisis fueron tranquilizadores. El análisis de orina es barato, fácil y rápido, y permite a los clínicos evaluar la posibilidad de un síndrome pulmón-riñón cuando evaluamos a un paciente con infiltrados pulmonares inexplicables. Por lo tanto, es el mejor test siguiente. La TAC y la broncoscopía son procedimientos más caros que deben ser considerados en algún punto de la evaluación diagnóstica pero que de entrada no ayudan a estrechar el diagnóstico diferencial eficientemente.
Diagnóstico diferencial: la infección con Pneumocystis jiroveci es una infección pulmonar oportunista en pacientes con infección por HIV mal controlada (Tabla 1). Típicamente se presenta como disnea de comienzo insidi oso, tos seca, y síntomas constitucionales asociados a infiltrados pulmonares bilaterales. En nuestro paciente, la ausencia de factores de riesgo de inmunocompromiso (por ejemplo uso a largo plazo de corticosteroides, u otra medicación inmunosupresora) y el test HIV negativo, descartan la posibilidad de infecció por Pneumocystis jiroveci.
oso, tos seca, y síntomas constitucionales asociados a infiltrados pulmonares bilaterales. En nuestro paciente, la ausencia de factores de riesgo de inmunocompromiso (por ejemplo uso a largo plazo de corticosteroides, u otra medicación inmunosupresora) y el test HIV negativo, descartan la posibilidad de infecció por Pneumocystis jiroveci.
El síndrome de Löffler consiste en infiltrados pulmonares que están asociados a eosinofilia periférica. Es originado por el pasaje transpulmonar de larvas de helmintos, fundamentalmente ascariasis. Nuestro paciente, muy improbablemente tenga este diagnóstico dado la ausencia de eosinofilia periférica y la carencia de riesgo de tener infección parasitaria.
Pacientes que tienen manifestaciones pulmonares del síndrome de Churg Strauss clásicamente se presentan con síntomas de asma refractaria severa. La ausencia de los hallazgos típicos de la enfermedad, ausencia de eosinofilia periférica, y ANCA negativos descarta el diagnóstico.
La neumonía criptogénica en organización es un trastorno inflamatorio de la pequeña vía aérea, ductos alveolares y alvéolos que frecuentemente mimetiza la neumonía adquirida en la comunidad en su presentación. Es un diagnóstico de exclusión. La hemorragia pulmonar que se encontró en el lavado broncoalveolar confirmó un diagnóstico alternativo de hemorragia alveolar difusa.
Ewan C. Goligher, MD* and Allan S. Detsky, MD PhD
*Department of Medicine; Department of Medicine and Department of Health Policy, Management and Evaluation, University of Toronto, Toronto, Ont.
CMAJ • January 6, 2009; 180 (1). doi:10.1503/cmaj.081117.
1. Bolton WK. Goodpasture's syndrome. Kidney Int 1996;50:1753-66.[Medline]
2. Donaghy M, Rees AJ. Cigarette smoking and lung hemorrhage in glomerulonephritis caused by autoantibodies to glomerular basement membrane. Lancet 1983;2:1390-2.[Medline]
3. Ball JA, Young KR Jr. Pulmonary manifestations of Goodpasture's syndrome, antiglomerular basement membrane disease and related disorders. Clin Chest Med 1998;19:777-91.[CrossRef][Medline]
4. Levy JB, Turner AN, Rees AJ, et al. Long-term outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med 2001;134:1033-42.[Abstract/Free Full Text]
martes, 24 de febrero de 2009
Amaurosis súbita fugaz. Fenómeno de Uhthoff. Uhthoff's phenomenon.
 lo relaciona con una ducha de agua muy caliente, produciéndose la recuperación de la visión “cuando el cuerpo se enfría” según palabras de la propia paciente.
lo relaciona con una ducha de agua muy caliente, produciéndose la recuperación de la visión “cuando el cuerpo se enfría” según palabras de la propia paciente.El examen físico que incluyó un examen neurológico completo y un fondo de ojo realizado en el consultorio por su clínico son normales.
No existen antecedentes médicos personales ni familiares de interés.
1) Eco Doppler de vasos de cuello
2) Eritrosedimentación y PCR cuantitativa.
3) TAC de cerebro.
4) Punción lumbar con investigación de bandas oligoclonales en LCR.
5) Potenciales evocados visuales
6) Interconsulta con psiquiatría
La respuesta correcta es la 5
Se trata del fenómeno o síntoma de Uhthoff (Uhthoff phenomenon), que es característico de enfermedades desmielinizantes que afectan el nervio óptico, clásicamente la esclerosis múltiple, más precisamente en la neuritis óptica. Pequeños aumentos de la temperatura corporal (hipertermia), causados por el ejercicio, baños calientes, pueden producir la aparición de los síntomas, desapareciendo los mismos cuando la temperatura corporal vuelve a lo anormal después de algunos minutos a pocas horas. Fué descripto en 1890 como ambliopía que sigue al ejercicio.
Una explicación podría ser que la hipertermia induce un neuro-bloqueo de los axones parcialmente desmielinizados. Otra teoría sugiere que el calor, produce un bloqueo de los canales iónicos de calcio, cambios circulatorios, expresión de proteínas de shock térmico y otras sustancias humorales no identificadas, que es un fenómeno característico de enfermedades desmielinizantes que afectan el nervio óptico, clásicamente la esclerosis múltiple, más precisamente en la neuritis óptica. Pequeños aumentos de la temperatura corporal (hipertermia), causados por el ejercicio, baños calientes, pueden producir la aparición de los síntomas, desapareciendo los mismos cuando la temperatura corporal vuelve a lo anormal después de algunos minutos a pocas horas.
lunes, 23 de febrero de 2009
Hipertrofia gingival. Leucemia mielomonocítica aguda (M4)
 sangrado de encías ante traumas menores. En el examen físico presentó hipertrofia de encías y rash petequial extenso. (Figura 1). Su hemoglobina era de 5,3 g/dl, el recuento de blancos era de 110.000/dl, y las plaquetas de 25.000/dl. Su coagulograma era normal. Una biopsia de médula ósea mostró una médula hipercelular con más de 50% de monoblastos y promonocitos (Figura 2)
sangrado de encías ante traumas menores. En el examen físico presentó hipertrofia de encías y rash petequial extenso. (Figura 1). Su hemoglobina era de 5,3 g/dl, el recuento de blancos era de 110.000/dl, y las plaquetas de 25.000/dl. Su coagulograma era normal. Una biopsia de médula ósea mostró una médula hipercelular con más de 50% de monoblastos y promonocitos (Figura 2) Figura 1: Hipertrofia gingival y rash petequial en tórax.
Figura 2: imágen histológica de biopsia de médula ósea mostrando médula hipercelular con promonocitos (flecha negra), monoblastos (flecha blanca) y mielocitos (cabezas de flecha)

(Clickear sobre las imágenes para ampliarlas).
Cual es el diagnóstico?
Los monocitos y monoblastos fueron positivos para CD14 y CD64. Se diagnosticó leucemia aguda mielomonocítica(M4). Después de la quimioterapia con daunorrubicina y citarabina su hipertrofia gingival y el rash petequial se resolvieron, y su recuento de blancos fue de 6.000/dl
Las células leucémicas ocasionalmente infiltran el sistema nervioso central, piel, hígado, bazo o encías en los tipos M3 y M4 de leucemia mieloide aguda.
Fuente:
Krishna Gundabolu, MD*, Guanghui Kong, MD PhD and Amit Verma, MD
*Department of Internal Medicine, Jacobi Medical Center, Albert Einstein College of Medicine; Department of Hemato-Pathology, Jacobi Medical Center, Albert Einstein College of Medicine; Department of Oncology, Albert Einstein College of Medicine, Bronx, NY
CMAJ. 17 February 2009, Volume 180, Issue 4
sábado, 21 de febrero de 2009
Una causa pesada…
Un hombre de 43 años fue hospitalizado debido a una historia de 3 días de dolor epigástrico en el cuadrante superior derecho y constipación. El dolor era intermitente y no estaba asociado a nauseas, vómitos, fiebre ni se exacerba con la alimentación.
El paciente había nacido en Israel de padres de origen Libio. Era comerciante y a menudo viajaba especialmente a España y Egipto. Él había tenido diabetes mellitus 2 por 6 años, para lo que había tomado gliburida 5 mg por día. Aproximadamente 13 meses antes de la presente admisión, él había sido hospitalizado en un hospital por neumonía de lóbulo inferior derecho, de la que se había recuperado completamente. Su historia familiar no revestía interés médico.
En el examen, el paciente refería un dolor epigástrico de gran severidad en cuadrante superior derecho. Su tensión arterial era de 150/90 mmHg, pulso regular de 110 latidos por minuto, y su temperatura de 36 ºC. Los sonidos cardíacos se auscultaban normales, y los pulmones estaban claros. Había severo dolor a la palpación del cuadrante superior derecho del abdomen conleve defensa pero sin dolor a la descompresión. El signo de Murphy estaba ausente, la peristalsis estaba levemente disminuída, y no había hematoma en la pared abdominal. No se encontraron déficit neurológicos. El examen rectal fue normal.
Las causas comunes de severo dolor en cuadrante superior derecho del abdomen y epigastrio son las enfermedades de la vesícula biliar y los trastornos gástricos. Así, la diabetes mellitus está asociada a una incidencia aumentada de gastritis e infección por Helicobacter pylori así como colelitiasis. La ausencia de fiebre, y de signo de Murphy, hacen improbable el diagnóstico de colecistitis, pero la colelitiasis no puede ser descartada. La ausencia de signos de abdomen agudo y la duración de los síntomas son incompatibles con el diagnóstico de úlcera duodenal perforada, aunque la exacerbación de enfermedad ulcerosa péptica, aún con penetración pancreática, así como gastritis aguda, no han sido descartadas todavía.
La diabetes 2 puede estar asociada a hiperquilomicronemia, que puede también causar pancreatitis aguda. La cetoacidosis diabética no parece ser una explicación razonable para este dolor abdominal, debido a que esta acompaña generalmente a la diabetes 1. El ileo manifestado por constipación y dolor abdominal asociado a neumonía de lóbulo inferior derecho no pueden descartarse todavía.
La concentración de hemoglobina era de 8,9 g/dl, con índices hematimétricos normales; el recuento de blancos era de 8300/mm3, con un conteo diferencial normal, y las plaquetas de 214000/mm3; la eritrosedimentación era de 40 mm por hora (por el método de Westergren). Los tests de laboratorio revelaron los siguientes resultados: glucemia 175 mg/dl, creatinina 1,2 mg/dl, bilirrubina total 1,9 mg/dl bilirrubina directa 0,5 mg/dl, FAL 83 U/L, gama glutamil transpeptidasa 85U/L, aspartato amino transferasa 46 U/L, alanino amino transferasa 97 U/L, albúmina4,4 g/l, colesterol total 189 mg/dl, triglicéridos 191 mg/dl, calcio 9,7 mg/dl y ácido úrico 5,9 mg/dl.
El tiempo de protrombina y los resultados de los análisis de orina fueron normales. La amilasa fue normal, así como la Rx simple de abdomen. La ecografía mostró vesícula normal e infiltración grasa del hígado. El páncreas no pudo ser visualizado claramente debido a la interposición de gas del intestino.
En base a estos resultados, yo descartaría los trastornos vesiculares y la obstrucción así como la perforación de intestino. Aunque el páncreas no puede ser claramente visto en la ecografía, la concentración normal de amilasa en suero no sugiere la presencia de pancreatitis. La hiperquilomicronemia, diabetes descompensada, y neumonía pueden ser descartadas. Los hallazgos notables son: la presencia de anemia normocítica normocrómica, que puede indicar pérdida de sangre en tubo digestivo; la hiperbilirrubinemia indirecta, que puede sugerir la presencia de hemólisis o de síndrome de Gilbert; y la alteración leve del hepatograma. En este momento yo estudiaría un trastorno gastrointestinal superior.
El paciente continuó reportando severo dolor abdominal superior intermitente, que ocurría varias veces en el día, cuando ocurría durante el sueño lo despertaba, y no tenía relación con la ingestión de alimentos. El dolor se agravaba por la palpación superficial del epigastrio. No era aliviado por la ingesta de antiácidos, bloqueantes H2 endovenosos, analgésicos ni AINES. El dolor era aliviado por inyecciones de meperidina, y al menos una vez con la inyección de placebo. El paciente presentaba un bajo grado de fiebre (37,4 a 37,8ºC). La repetición de los tests de sangre mostraron una concentración de hemoglobina estable y anormalidades hepáticas persistentes. La concentración de hierro sérico era de 150 mg/dl, y el conteo de reticulocitos era de 45%. La concentración de transferrina, haptoglobina, vitamina B12, ácido fólico y glucosa 6 fosfato deshidrogenasa estaban dentro de los límites normales. Las muestras de materia fecal fueron negativas para la investigación de sangre. Una seriada gastroduodenal con bario no mostró alteraciones del esófago estómago ni parte alta del intestino delgado. Una TAC abdominal reveló una leve distensión del colon, infiltración grasa leve del hígado, y resto sin particularidades. El resultado de la endoscopía digestiva alta y colonoscopía fueron normales.
Es hora de buscar una explicación menos común del severo dolor abdominal. La diabetes puede estar asociada a aterosclerosis prematura, que puede causar angina abdominal. Sin embargo, la presentación clínica de este paciente no parecen corresponder a esa causa, debido a que su diabetes 2 es de relativo reciente comienzo y ha estado bien controlada. Aunque no está indicada la angiografía mesentérica un eco doppler podría ser de ayuda.
En ausencia de evidencia de daño neurológico, la neuropatía diabética no impresiona como probable. La fiebre mediterránea familiar es caracterizada por episodios recurrentes de dolor abdominal, peritonitis, pleuresía, fiebre y artritis que duran 24 a 96 horas. El background étnico del paciente es consistente con la posibilidad de fiebre mediterránea familiar, pero dado la ausencia de antecedentes familiares, la ausencia de presentación característica de la enfermedad, y el hecho de que el dolor abdominal es de reciente comienzo, hacen que dicho diagnóstico sea improbable. La respuesta del paciente a la inyección de placebo agrega la posibilidad de una causa psicológica del dolor, aunque dejarían sin explicación la anemia y las alteraciones de los tests de funcionamiento hepático.
Antes de llevar a cabo una evaluación psicológica, yo investigaría las restantes causas raras de dolor abdominal: defieciencia de el inhibidor de C1 esterasa, porfiria, y intoxicación con metales pesados.
Un doppler duplex color de la mesentérica superior no mostró trastornos del flujo. La excreción urinaria de porfirinas estaba elevada: ácido aminolevulínico 204 mg por día .
Cual es el diagnóstico?
Este perfil bioquímico puede ser atribuido a un ataque agudo de neuroporfiria. Las manifestaciones clínicas de porfiria varian y pueden consistir en dolor abdominal, neuropatía periférica y trastornos mentales con o sin fotosensibilidad. La presencia de porfiria puede ciertamente explicar los síntomas de este paciente, los resultados alterados de los tests de funcionamiento hepático, y posiblemente la anemia, pero, que hay acerca de la ausencia antecedentes familiares de porfiria? (habitualmente un rasgo autosómico dominante) y la de ausencia de antecedentes de dolor abdominal? Necesitamos explorar las causas de excreción elevada de porfirinas y sus precursores. Esto es debido a un ataque agudo de porfiria o a alguna otra causa, tal como enfermedad hepática o intoxicación por metales pesados ?
El paciente negó el uso de barbitúricos, anticonvulsivantes, u hormonas, y él tomaba alcohol solo socialmente. La concentración de porfirinas y sus precursores en orina, heces y sangre, y la actividad enzimática fueron medidos y se determinó que no correspondía a ningún tipo específico de porfiria. Más aún, el hallazgo de la concentración urinaria de ácido aminolevulínico 41 veces mayor de lo normal, contrastaba con un valor de porfobilinógeno solo aumentado 4 veces, lo que hizo sospechar intoxicación con metales pesados (probablemente plomo).
La excreción urinaria de plomo era de 651 ug/día.
El cuadro clínico comienza a aclararse. La intoxicación por plomo causa dolor abdominal e irritabilidad y puede explicar la anemia con punteado basófilo, las anormalidades de los tests de función hepáticas, y las anormalidades en la síntesis de porfirinas. Para tratar los síntomas y corregir la alta concentración de plomo en sangre está indicado un quelante.
Se administró ácido meso 2, 3-dimercaptosuccínico durante 5 días a una dosis de 30 mg/kg de peso corporal, después de lo cual se bajó la dosis a 20 mg/kg por otras dos semanas. El paciente se volvió asintomático. Un mes más tarde, la función hepática volvió a lo normal, la hemoglobina era de 12,5 g/dl y las anormalidades del metabolismo de las porfirinas eran mucho menos severas. Lo único que todavía no termina de cerrar el cuadro es el origen de la intoxicación con plomo. El paciente negó exposición a plomo o productos que lo contengan, tal como gasolina, pinturas, y cañerías de plomo. Alrededor de 3 meses antes del ingreso, sin embargo, él había comenzado a tomar 2 tabletas de “plantas de la India” por día Las tabletas habían sido expendidas en un envase plástico no rotulado. Esas tabletas las había obtenido de una persona a la que había consultado por su diabetes. El paciente gradualmente fue aumentando la dosis diaria hasta 8 por día. El examen toxicológico de las tabletas mostraron que cada tableta contenía 10 mg de plomo. Así la ingesta acumulada antes de la internación era de aproximadamente 4 g.
Comentario: En este paciente, la concentración anormal de porfirinas fue la primer pista para establecer un diagnóstico correcto. Las porfirias pueden ser clasificadas en base a los síntomas clínicos como neuroporfirias, porfirias cutáneas, o trastornos mixtos, (1) mientras que la clasificación tradicional (eritropoyética o hepática) está basada en la localizacióndel trastorno. Las manifestaciones clínicas varían dependiendo del tipo de porfiria. (2) En este paciente, aunque los síntomasy los resultados de laboratorio eran consistentes con el diagnóstico de porfiria, la ausencia de historia familiar de la enfermedad, y la ausencia de factores precipitantes conocidos (tal como el uso de drogas) condujo a la búsqueda de otra causa de porfirinuria. Así, la intoxicación crónica con plomo, una causa conocida de porfiria adquirida, fue la mejor explicación. La determinación del origen (un preparado de hierbas), y la desaparición de los síntomas, anemia, y anormalidades de laboratorio después de la discontinuación del preparado resolvieron el rompecabezas Este caso subraya la importancia del bien establecido, aunque muchas veces olvidado hecho de que las porfirinurias no establecen necesariamente el diagnóstico de porfiria. En este paciente, la intoxicación crónica por plomo explica todos los hallazgos. El dolor abdominal, debilidad, irritabilidad, y trastornos neuropsiquiátricos son síntomas comunesde intoxicación por plomo en adultos, aunque muchos pacientes están asintomáticos. La anemia normocítica con punteado basófilo, tests de función hepática alterados, y concentración anormal de porfirinas son hallazgos característicos de laboratorio. (3) En adultos, la intoxicación crónica por plomo es debida generalmente a exposición ocupacional, especialmente en personas afectadas a la manufactura de pinturas, gasolina y baterias. Sin embargo, las preparaciones de hierbas son una causa recientemente identificada de fuente de plomo y otros metales pesados. El uso de medicinas alternativas, incluyendo tratamiento con hierbas están ganando popularidad, Un estudio de sondeo en Estados Unidos encontró que un tercio de la población había usado alguna forma de medicina alternativa al menos una vez, (4) y en Australia, aproximadamente la mitad de la población reportó el uso de medicinas alternativas. (5) Aunque los medicamentos herbarios son usualmente percibidos como naturales, y así, desprovistos de efectos colaterales, pueden tener materiales tóxicos. (6) La contaminación con plomo de remedios tradicionales de Asia (encontrados en más del 60% de tales productos cuando se miden por peso), así como la contaminación con otros metales pesados está bien documentada. (7,8,9,10,11,12) De hecho, ha habido reportes de intoxicación por plomo de plantas de la India en pacientes con diabetes. (13,14) Pudo haberse hecho antes el diagnóstico, y así evitado algunos de los sofisticados y costosos tests diagnósticos? Un alto índice de sospecha basado en la historia médica, el examen físico, una evaluación completa y la prevalencia de una enfermedad específica es el primer paso en establecer el diagnóstico. Una historia médica completa, incluyendo terapia con drogas, previas y actuales debe ser obtenida al momento de la internación. Sin embargo, algunos pacientes no consideran drogas a los medicamentos herbarios, mientras que otros se sienten incómodos comunicando este antecedente a los profesionales. Eisenberg y col (4) encontraron que más de 72% de los pacientes quienes usaban tratamientos no convencionales no lo informaban a sus médicos. Así, como parte integral al tomar la historia clínica, los clínicos deben esforzarse en interrogar a los pacientes acerca del uso de medicinas no convencionales. En este caso, si los clínicos hubieran estado enterados de que el paciente consumía preparaciones herbarias el diagnóstico se hubiera alcanzado antes.
Traducido de “A leading question”. Clinical problem-solving. The New England of Medicine. September 17,1998 Origen de la información From the Department of Internal Medicine A (Y.B., I.O.) and the Porphyria Reference Laboratory (N.S.), Rabin Medical Center, Petach Tikva, and the Sackler Faculty of Medicine, Tel Aviv University, Tel Aviv — both in Israel. Address reprint requests to Dr. Beigel at the Department of Internal Medicine A, Rabin Medical Center, Beilinson Campus, Petach Tikva 49100, Israel. References 1) Tefferi A, Colgan JP, Solberg LA Jr. Acute porphyrias: diagnosis and management. Mayo Clin Proc 1994;69:991-995.[Medline]
2) Kappas A, Sassa S, Galbraith RA, Nordmann Y. The porphyrias. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The metabolic and molecular bases of inherited disease. 7th ed. Vol. 2. New York: McGraw-Hill, 1995:2103-59.
3) Cullen MR, Robins JM, Eskenazi B. Adult inorganic lead intoxication: presentation of 31 new cases and a review of recent advances in the literature. Medicine (Baltimore) 1983;62:221-247.[Medline]
4) Eisenberg DM, Kessler RC, Foster C, Norlock FE, Calkins DR, Delbanco TL. Unconventional medicine in the United States: prevalence, costs, and patterns of use. N Engl J Med 1993;328:246-252. [Abstract/Full Text]
5) MacLennan AH, Wilson DH, Taylor AW. Prevalence and cost of alternative medicine in Australia. Lancet 1996;347:569-573.[Medline]
6) Abbot NC, White AR, Ernst E. Complementary medicine. Nature 1996;381:361-361.[Medline]
7) Woolf GM, Petrovic LM, Rojter SE, et al. Acute hepatitis associated with the Chinese herbal product jin bu huan. Ann Intern Med 1994;121:729-735. [Abstract/Full Text]
8) Mitchell-Heggs CAW, Conway M, Cassar J. Herbal medicine as a cause of combined lead and arsenic poisoning. Hum Exp Toxicol 1990;9:195-196.[Medline]
9) Smitherman J, Harber P. A case of mistaken identity: herbal medicine as a cause of lead toxicity. Am J Ind Med 1991;20:795-798.[Medline]
10) Markowitz SB, Nunez CM, Klitzman S, et al. Lead poisoning due to hai ge fen: the porphyrin content of individual erythrocytes. JAMA 1994;271:932-934.[Abstract]
11) Bayly GR, Braithwaite RA, Sheehan TMT, Dyer NH, Grimley C, Ferner RF. Lead poisoning from Asian traditional remedies in the West Midlands -- report of a series of five cases. Hum Exp Toxicol 1995;14:24-28.[Medline]
12) Kew J, Morris C, Aihie A, Fysh R, Jones S, Brooks D. Arsenic and mercury intoxication due to Indian ethnic remedies. BMJ 1993;306:506-507.[Medline]
13) Pontifex AH, Garg AK. Lead poisoning from an Asian Indian folk remedy. Can Med Assoc J 1985;133:1227-1228.[Medline]
14) Keen RW, Deacon AC, Delves HT, Moreton JA, Frost PG
martes, 10 de febrero de 2009
Pseudocoartación de aorta abdominal
Figura 1 Reconstrucción de volumen de una TAC (vista anteroposterior) mostrando una pseudocoartación aórtica abdominal (flecha negra) La extrema redundancia del segmento afectado de la aorta es claramente visible (flecha blanca
Figura 2
Reconstrucción oblicua coronal de una TAC que muestra la relación de la pseudocoartación aórtica abdominal(flecha blanca) con el riñón izquierdo (flecha negra)

 Figura 3
Figura 3Reconstrucción sagital de una TAC de cavidad tóraco abdominal. La aorta abdominal es de tamaño normal, sin obstrucción luminal
La pseudocoartación aórtica abdominal es muy rara. Solo 4 casos han sido descriptos hasta la fecha. (1) Es similar a la condición de pseudocoartación aórtica torácica que es mucho mas frecuente, con marcada redundancia de un segmento de la aorta sin estenosis funcional. El segmento redundante, tortuoso no tiene circulación colateral.
La aorta abdominal se desarrolla normalmente por un proceso de fusión de la aorta dorsal alrededor del día 25 del desarrollo fetal. (2) Los trastornos de la fusión son propuestos como causas de una variedad de anomalías vasculares en esta región del cuerpo, como la coartación aórtica abdomnal, la hipoplasia aórtica abdominal, y la aorta de canal dual, la interrupción aórtica y la pseudocoartación.
El reconocimiento de estas anomalías aumentó desde el advenimiento de las imágenes de de sección cruzada y de angiografía.
La pseudocoartación aórtica debe ser considerada una condición benigna.
Fuente:
Abdominal aortic pseudocoarctation
Roya Etemad-Rezai, MD and Richard N. Rankin, MB ChB
From the Department of Medical Imaging, University Hospital, London Health Sciences Centre, London, Ont.
Canadian Medical Association Journal (CMAJ) 03/02/2009
Bibligrafía:
1) Schellhammer F, von den Driesch P, Gaitzsch A. Pseudocoarctation of the abdominal aorta. Vasa 1997;26:308-10.[Medline]
2. 2) Arnot RS, Louw JH. The anatomy of the posterior wall of the abdominal aorta. Its significance with regard to hypoplasia of the distal aorta. S Afr Med J 1973;47:899-902.[Medline]
lunes, 9 de febrero de 2009
Una duda clínica común.
Un hombre de 60 años concurrió al hospital debido a sibilancias intermitentes, disnea de esfuerzo progresiva, y severa ortopnea, que había estado presente por varias semanas. El paciente había presentado ocasionalmente una presión vaga en el pecho que no estaba claramente asociada a los esfuerzos. En la sala de emergencias, el paciente respiraba con dificultad, y la saturación de oxígeno era de 84% respirando aire ambiente. En el examen físico su TA era de 192/78 mm Hg. Tenía rales bibasales, un ritmo de galope, y un soplo carotídeo derecho. El electrocardiograma no mostró anormalidades, y la Rx de tórax demostró un corazón de tamaño normal y una leve congestión vascular.
La presencia de ritmo de galope usualmente indica una elevación sustancial en la presión de fin de diástole ventricular izquierda. Esto me hace sospechar que el paciente puede tener una cardiomiopatía dilatada que causa fallo ventricular izquierdo. La presencia de soplo carotídeo me hace sospechar que la causa de la insuficiencia cardíaca sea una enfermedad coronaria.
Los factores de riesgo del paciente incluian hipertensión de larga data, hiperlipemia, diabetes mellitus de reciente comienzo, y una historia familiar de enfermedad cerebrovascular prematura, pero no enfermedad coronaria. Seis meses antes él había sido internado por insuficiencia cardíaca congestiva, y el resultado de la perfusión con tecnecio 99 sestamibi fue consistente con la presencia de isquemia de cara inferior. Se le recomendó cateterización cardíaca, pero el paciente rechazó la indicación y fue dado de alta con tratamiento médico.
La combinación de factores de riesgo en este paciente configura un síndrome metabólico con resistencia a la insulina, que se asocia a enfermedad vascular periférica y a enfermedad coronaria. La presentación clínica y los resultados del scan de perfusión, así como la presencia de varios factores de riesgo cardiovascular confirman la sospecha inicial de enfermedad arterial coronaria. La combinación de anormalidades reversibles en las imágenes de perfusión, y un corazón de tamaño normal en la Rx de tórax sugieren un fallo cardíaco con un componente isquémico reversible. Sospecho que si se hubiera usado talio en la perfusión en lugar de sestamibi, hubiese habido una captación sustancial del agente por los pulmones. La combinación de enfermedad arterial coronaria, y fallo cardíaco congestivo en este paciente me hacen indicar fuertemente un cateterismo coronario.
El paciente ahora si, estuvo de acuerdo en llevar a cabo un cateterismo cardíaco. La presión de llenado ventricular izquierdo y la función sistólica fueron normales. Una moderada a severa estenosis del tronco de la coronaria izquierda, y severa estenosis de la arteria descendente anterior izquierda y de la circunfleja fueron identificadas en el procedimiento. Además, la porción proximal de la arteria coronaria derecha estaba totalmente ocluída y tenía circulación colateral por el sistema de la coronaria izquierda. El soplo de la carótida derecha fue evaluado con doppler , y se vió una estenosis crítica de la carótida interna derecha y una estenosis moderada de la carótida interna izquierda. Esos
 hallazgos fueron confirmados por angiografía (Figura 1 A), que también documentó flujo reducido en la porción distal de la arteria carótida interna derecha.
hallazgos fueron confirmados por angiografía (Figura 1 A), que también documentó flujo reducido en la porción distal de la arteria carótida interna derecha.Se recomendó en este paciente la posibilidad de realizar revascularización combinada de carótidas y coronarias, pero el riesgo de ACV y de infarto agudo de miocardio fueron discutidos. El paciente expresó preocupación acerca de potenciales complicaciones y abandonó el hospital contra el consejo de los médicos.
Menos de una semana más tarde, el paciente fue readmitido al hospital por fallo cardíaco congestivo recurrente. Un protocolo de investigación de colocación de stents percutáneos de ambas carótidas, que había sido aprobado por un comité del hospital, fue discutido como una opciónen este paciente, quien prefirió este procedimiento a la revascularización quirúrgica combinada.
Se llevó a cabo una angioplastia de la carótida interna que fue exitosa, colocándose un stent por vía percutánea (Figura 1 B y Figura 2) No hubo estenosis residual, y el flujo sanguíneo en la porción distal de la arteria carótida interna volvió a lo normal. Tres días más tarde, el paciente se sometió exi
 tosamente a una cirugía de revascularización coronaria, realizándose 4 puentes coronarios, dándosele el alta hospitalaria 4 días más tarde. El paciente permaneció bien durante un seguimiento a los 6 meses susecuentes,y el eco doppler de la región del stent carotídeo no reveló estenosis.
tosamente a una cirugía de revascularización coronaria, realizándose 4 puentes coronarios, dándosele el alta hospitalaria 4 días más tarde. El paciente permaneció bien durante un seguimiento a los 6 meses susecuentes,y el eco doppler de la región del stent carotídeo no reveló estenosis.Comentario:
Aunque la tasa combinada de stroke y muerte asociada con cirugía de by pass aislada es de 5 a 6% aproximadamente, (2,3) no hay consenso en esas tasas con respecto a la endarterectomía aislada. Las variaciones de las tasas de complicaciones de endarterctomías aisladas, hacen difícil estimar el riesgo del procedimiento en etapas. Un estudio de Rothwell y col (4) ofrece una posible explicación para esta variación. Los autores analizaron las tasas de complicaciones asociadas a endarterectomías en pacientes con estenosis carotídeas sintomáticas en 51 artículos presentados, representando casi 16.000 operaciones desde 1980 a 1995, y concluyeron que la tasa total de stroke o muerte fue de 5,6%. Sin embargo, estudios en que un único cirujano llevó a cabo todas las operaciones reportaron una tasa de 2,3%, y estudios en que un neurólogo evaluó los resultados quirúrgicos reportaron un riesgo combinado de stroke o muerte de 7,7%. Las variaciones en los resultados pueden estar también relacionados a diferencias en el riesgo operatorio en varias cohortes. Los pacientes que se someten a endarterectomía como paso previo a la cirugía de by pass coronario , y aquellos con hipertensión arterial severa, trombos en la carótida interna o edad avanzada están en mayor riesgo de complicaciones. (5)
Reportes publicados de endarterectomía combinada con cirugía de by pass coronario en pacientes no seleccionados sugiere que el riesgo de stroke o muerte va de 7,4 a 9,4%. Más o menos 1,5 a 2 veces el riesgo de cada operación por separado. (1,6,7) A pesar del riesgo aumentado, el procedimiento combinado es generalmente preferido a la cirugía por pasos, (6) aunque las opiniones varian, debido a la falta de datos que avalen una u otra elección.
El uso de angioplastía carotídea sin colocación de stent ha sido descripta esporádicamente en la literatura desde el comienzo de los 1980s. (8,9,10,11,12) La aplicación de este procedimiento ha estado limitado por preocupación acerca de embolismo cerebral desde el sitio de la angioplastía, cierre abrupto con consecuencias neurológicas catastróficas, resultados angiográficos subóptimos, y reestenosis. Además, la efectividad y el bajo riesgo asociado a la endarterectomía redujo los incentivos de terapias alternativas. Recientemente, avances en la tecnología han permitido el uso de rutina de stents para revascularización, lo que ha conducido a un marcado mejoramiento de los procedimientos durante los mismos y de los resultados a largo plazo. En un estudio multicéntrico de stent carotídeo en 543 pacientes, el procedimiento fue exitoso en 97% de los casos y la tasa de stroke fue de 3,3%. (13) Más aún, otros investigadores han demostrado que la durabilidad y los resultados neurológicos tardíos son similares a los de la endarterectomía. (14) Otros riesgos asociados con la endarterectomía incluyen, infarto agudo de miocardio , infección, y parálisis facial no ocurren con el stenting. Además, a esos promisorios resultados clínicos, los análisis preliminares de costos mostraron que la angioplastía con stenting fue sustancialmente menos cara que la endarterectomía. Específicamente, la extensión de la hospitalización para el stenting carotídeo fue aproximadamente la mitad de la endarterectomía, y el costo fue aproximadamente un tercio de la endarterectomía.
Nuestro paciente con severa enfermedad coronaria sintomática y disfunción ventricular izquierda isquémica fue exitosamente tratado con stenting carotídeo percutáneo antes que la cirugía de by-pass. El uso de stent carotídeo en tales pacientes puede reducir el riesgo total de stroke y muerte, aunque (al momento de ser escrito el presente caso) se requiere más experiencia para testear esta hipótesis.
William A. Gray, M.D., Robert J. DuBroff, M.D., and Harvey J. White, M.D.
From Southwest Cardiology Associates, Presbyterian Hospital, Albuquerque, N.M.
Address reprint requests to Dr. Gray at Southwest Cardiology Associates, 1101 Medical Arts Ave. N.E., Bldg. 5, Albuquerque, NM 87102.
References
1) Akins CW, Moncure AC, Daggett WM, et al. Safety and efficacy of concomitant carotid and coronary artery operations. Ann Thorac Surg 1995;60:311-318. [Abstract/Full Text]
2) Clark RE. The STS Cardiac Surgery National Database: an update. Ann Thorac Surg 1995;59:1376-1381. [Abstract/Full Text]
3) Augulakis A, Kalodiki E, Nicolaides AN. Combined carotid endarterectomy and coronary artery bypass grafting: a literature review. Int Angiol 1991;10:167-172.[Medline]
4) Rothwell PM, Slattery J, Warlow CP. A systematic review of the risks of stroke and death due to endarterectomy for symptomatic carotid stenosis. Stroke 1996;27:260-265. [Abstract/Full Text]
5) McCrory DS, Goldstein LB, Samsa GP, et al. Predicting complications of carotid endarterectomy. Stroke 1993;24:1285-1291.[Abstract]
6) Rizzo RJ, Whittemore AD, Couper GS, et al. Combined carotid and coronary revascularization: the preferred approach to the severe vasculopath. Ann Thorac Surg 1992;54:1099-1109.[Abstract]
7)Daily PO, Freeman RK, Dembitsky WP, et al. Cost reduction by combined carotid endarterectomy and coronary artery bypass grafting. J Thorac Cardiovasc Surg 1996;111:1185-1193. [Abstract/Full Text]
8) Hasso AN, Bird CR, Zinke DE, Thompson JR. Fibromuscular dysplasia of the internal carotid artery: percutaneous transluminal angioplasty. AJR Am J Roentgenol 1981;136:955-960.[Medline]
9) Wiggli U, Gratzl O. Transluminal angioplasty of stenotic carotid arteries: case reports and protocol. AJNR Am J Neuroradiol 1983;4:793-795.[Abstract]
10) Theron J, Courtheoux P, Henriet JP, Pelouze G, Derlon JM, Maiza D. Angioplasty of supraaortic arteries. J Neuroradiol 1984;11:187-200.[Medline]
11) Tsai FY, Matovich V, Hieshima G, et al. Percutaneous transluminal angioplasty of the carotid artery. AJNR Am J Neuroradiol 1986;7:349-358.[Abstract]
12) Theron J, Raymond J, Casasco A, Courtheoux F. Percutaneous angioplasty of atherosclerotic and postsurgical stenosis of carotid arteries. AJNR Am J Neuroradiol 1987;8:495-500.[Abstract]
13) Iyer SS, Roubin GS, Yadav JS, et al. Angioplasty and stenting for extracranial carotid stenosis: multicenter experience. Circulation 1996;94:Suppl I:I-58.abstract
14) Yadav JS, Roubin GS, Vitek J, et al. Late outcome after carotid angioplasty and stenting. Circulation 1996;94:Suppl I:I-58.abstract
viernes, 6 de febrero de 2009
Cual es el diagnóstico? Enfermedad de Degos (papulosis atrófica maligna)
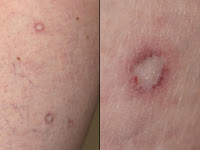 as eritematosas a rosadas, con un centro un centro cicatrizal blanco aporcelanado y un anillo telangiectásico, asintomáticas. (Figura 1) Un número progresivo de lesiones desarrolló en su abdomen, dorso y muslos. La histología de la piel mostró atrofia epidérmica, una interfase vacuolar y un área de bordes definidos de degeneración colágena y esclerosis dérmica papilar. Los resultados de las investigaciones figuran en la tabla.
as eritematosas a rosadas, con un centro un centro cicatrizal blanco aporcelanado y un anillo telangiectásico, asintomáticas. (Figura 1) Un número progresivo de lesiones desarrolló en su abdomen, dorso y muslos. La histología de la piel mostró atrofia epidérmica, una interfase vacuolar y un área de bordes definidos de degeneración colágena y esclerosis dérmica papilar. Los resultados de las investigaciones figuran en la tabla.
Cual es el diagnótico?
A) Liquen escleroso.
B) Morfea guttata
C)Lupus eritematoso sistémico
D) Papulosis atrófica maligna
E) Atrophie blanche blanca
Respuesta correcta: D
Discusión
Basados en los hallazgos clínicos y patológicos, la respuesta correcta es la (D), papulosis atrófica maligna (también conocida como enfermedad de Degos).
Esta condición es rara pero potencialmente fatal, consistente en una arteriopatía oclusiva de vasos pequeños y medianos. Algunos pacientes pueden tener una variante benigna de la enfermedad que está limitada a la piel (variedad benigna de la papulosis atrófica cutánea maligna). Sin embargo, hallazgos id énticos de piel pueden anteceder a la variante letal de compromiso multiorgánico (papulosis atrófica sistémica maligna). La ausencia de compromiso de órganos internos después de 3 años sugiere que nuestro paciente tiene una variante cutánea benigna. Solo el tiempo dirá si desarrolla o no enfermedad sistémica.
énticos de piel pueden anteceder a la variante letal de compromiso multiorgánico (papulosis atrófica sistémica maligna). La ausencia de compromiso de órganos internos después de 3 años sugiere que nuestro paciente tiene una variante cutánea benigna. Solo el tiempo dirá si desarrolla o no enfermedad sistémica.
Más de 200 casos de papulosis atrófica maligna, incluyendo tanto la forma cutánea benigna como la forma sistémica han sido publicadas. (1) Sin embargo, la enfermedad es probablemente subdiagnosticada. Típicamente, la papulosis atrófica maligna ocurre en adultos jóvenes de raza blanca, a menudo en la tercera década de la vida. Ha sido descripto en pacientes de todas las edades y grupos étnicos. En 1997, Katz describió una forma familiar de papulosis atrófica maligna con una relación hombre/mujer de 3 a 1. (2) La forma benigna es más comúnmente reportada en mujeres, con una relación mujer/hombre de 3 a 1. (3)
Los hallazgos patognomónicos tanto en la forma cutánea benigna como en la forma sistémica de papulosis atrófica maligna son las pápulas d esde eritematosas a rosadas de 2 a 15 mm de diámetro que desarrollan una cicatriz atrófica blanca aporcelanada en el centro de la lesión. Las pápulas están a menudo rodeadas por un anillo de telangiectasias, pueden tener forma de domo o apariencia de trébol. El promedio del número de pápulas es alrededor de 30. Sin embargo, más de 600 lesiones se han descripto en un paciente. (1) La superficie corporal proximal, genitales y dorso, son los más a menudo comprometidos. La cara, palmas y plantas son habitualmente respetadas. Aunque las lesiones son habitualmente asintomáticas, algunos pacientes pueden experimentar sensaciones de quemadura.
esde eritematosas a rosadas de 2 a 15 mm de diámetro que desarrollan una cicatriz atrófica blanca aporcelanada en el centro de la lesión. Las pápulas están a menudo rodeadas por un anillo de telangiectasias, pueden tener forma de domo o apariencia de trébol. El promedio del número de pápulas es alrededor de 30. Sin embargo, más de 600 lesiones se han descripto en un paciente. (1) La superficie corporal proximal, genitales y dorso, son los más a menudo comprometidos. La cara, palmas y plantas son habitualmente respetadas. Aunque las lesiones son habitualmente asintomáticas, algunos pacientes pueden experimentar sensaciones de quemadura.
La evaluación histopatológica de la biopsia de piel es requerida para diagnosticar papulosis atrófica maligna y distinguir estas lesiones de otras entidades con similar presentación como la atrophie blanche, el lupus eritematoso sistémico, la dermatomiositis, esclerodermia, liquen escleroso en gota, la mucinosis dérmica, y el síndrome antifosfolipídico. Los característicos hallazgos histológicos son áreas bien demarcadas de degeneración colágena y una reacción de interfase con aspecto escamoso de la unión dermo-epidérmica, una zona de esclerosis dérmica papilar, incontinencia melánica y atrofia epidérmica (Figura 2). (1) Las lesiones tempranas tienen infiltrados inflamatorios perivasculares, perianexiales, y perineurales con deposición de mucina. (1) La inflamación y proliferación de las células endoteliales y la trombosis pueden ser vistas debajo de la zona de necrobiosis. (1) Histológicamente, las lesiones de la variante cutánea benigna y la variable sistémica son indistinguibles.
Las lesiones de piel son a menudo la primer manifestación y heraldos de el inicio de la papulosis atrófica maligna sistémica. La forma sistémica es a menudo fatal, y típicamente desarrolla dentro de semanas a años después del inicio de las lesiones de piel. El compromiso de órganos internos raramente precede al inicio de la enfermedad cutánea. Los sistemas gastrointestinal, neurológico, oftalmológico, cardiopulmonar y hepato renal pueden estar afectados. Sin embargo, la perforación intestinal permanece la primer causa de muerte. (2) Los accidentes cerebro vasculares isquémicos o hemorrágicos, polirradiculoneuropatías discapacitantes y los síntomas neurológicos inespecíficos están entre las complicaciones de la papulosis atrófica maligna. (4) Las complicaciones oculares de la variante sistémica incluyen cataratas subcapsulares posteriores, diplopía, alteraciones en los campos visuales, ptosis, parálisis óculo motoras, atrofia y neuritis óptica, edema de papila y placas esclerales. (5) La pericarditis constrictiva, pleuritis, derrames pleurales, y muerte por infarto agudo de miocardio han sido reportadas. (1) Finalmente, han sido descriptas vasculitis en el síndrome hepatorenal. (1) En pacientes con papulosis atrófica maligna variante sistémica, la muerte ocurre dentro de los 2 o 3 años del comienzo de compromiso de órganos internos.(2) No hay tests de laboratorio específicos disponibles para distinguir las formas benignas de las sistémicas. Debido a que la forma sitémica es frecuentemente fatal, los pacientes asintomáticos con enfermedad de piel a menudo tienen ansiedad y depresión. Se han intentado múltiples tratamientos pero con poca efectividad. Una pequeña serie de casos sugiere que los agentes antiplaquetas (ácido acetil salicílico, y dipiridamol) e inmunoglobulina intravenosa pueden prevenir la progresión de la enfermedad. (1,6) En nuestra paciente, se administró bajas dosis de aspirina (81 mg/día) que previnieron la aparición de nuevas lesiones . No encontramos evidencias de compromiso sistémico después de un seguimiento de 3 años
Fuente: *Division of Dermatology, Department of Medicine, University of Calgary; Department of Pathology and Laboratory Medicine, University of Calgary, and Calgary Laboratory Services, Calgary, Alta.
Publicado en el CMAJ (Canadian Medical Association Journal)
November 18, 2008; 179 (11). doi:10.1503/cmaj.080373.
Bibliografía
1) 1) Scheinfeld N. Malignant atrophic papulosis. Clin Exp Dermatol 2007;32:483-7.[CrossRef][Medline]
2) 2) Katz SK, Mudd LJ, Roenigk HH Jr. Malignant atrophic papulosis (Degos' disease) involving three generations of a family. J Am Acad Dermatol 1997;37:480-4.[CrossRef][Medline]
3)3) Wilson J, Walling HW, Stone MS. Benign cutaneous Degos disease in a 16-year-old girl. Pediatr Dermatol 2007;24:18-24.[Medline]
4) 4) Subbiah P, Wijdicks E, Muenter M, et al. Skin lesion with a fatal neurologic outcome (Degos'disease). Neurology 1996;46:636-40.[Free Full Text]
5) 5) Egan R, Lessell S. Posterior subcapsular cataracts in Degos disease. Am J Ophthalmol 2000;129:806-7.[CrossRef][Medline]
6) 6) Zhu KJ, Zhou Q, Lin AH, et al. The use of intravenous immunoglobulin in cutaneous and recurrent perforating intestinal Degos disease (malignant atrophic papulosis). Br J Dermatol 2007;157:206-7.[CrossRef
Mejor respuesta
Estudios de laboratorio:
Repetición de calcio sérico en ayunas 10,9 mg/dl.
Hormona paratiroidea intacta en plasma 86 pg/ml.
Excreción urinaria de calcio 344 mg/24 hs.
Un estudio reciente de la densidad mineral ósea mediante absorciometría de rayos X de energía dual mostró resultados normales, con una densidad ósea de 0,9 desvíos estándar por debajo de la masa ósea pico en cuello femoral izquierdo, y 0,4 desvíos estándar por debajo de la masa ósea pico en columna lumbar.
La recomendación más apropiada en este momento es:
A) Comenzar con hidroclorotiazida 25 mg cuatro veces al día.
B) Comenzar un tratamiento con fosfatos por vía oral.
C) Derivar a la paciente para una paratiroidectomía.
D) Comenzar el tratamiento con bifosfonatos por vía oral.
E) Comenzar calcitonina nasal.
Respuesta correcta: C
Objetivo educacional: reconocer las indicaciones para la paratiroidectomía en una paciente con hiperparatiroidismo primario.
Aunque esta mujer de 63 años de edad parece relativamente asintomática por su hiperparatiroidismo leve, tiene antecedentes de nefrolitiasis, presumiblemente por cálculos de oxalato de calcio. Aunque no ha tenido un episodio de cólico renal en tres años, continúa teniendo un elevado riesgo de formación de cálculos y futuros síntomas debido a su importante hipercalciuria (>4 mg/kg por día) a pesar de la dieta de una insuficiencia renal leve, la que puede estar relacionada con su calculosis, o quizás con la enfermedad tubulointersticial inducida por calcio.
La paratiroidectomía probablemente llevará a la normalización del calcio sérico y urinario, y reducirá el riesgo de futuros cálculos en las vías urinarias. Las evidencias recientes sugieren una mejoría postquirúrgica en la densidad mineral ósea.
Aunque la hidroclorotiazida puede disminuir la excreción de calcio urinario, también puede aumentar el calcio plasmático, y está relativamente contraindicada en pacientes con hiperparatiroidismo primario.
Los fosfatos neutros por vía oral disminuyen la absorción intestinal de calcio mediante la formación de complejos intraluminales, y quizás a través de un efecto indirecto al disminuir los niveles circulantes de 1,25-dihidroxivitamina D. Sin embargo, a menos que estos agentes sean administrados en forma prudente, se puede producir un incremento significativo de los niveles plasmáticos de fósforo inorgánico. En pacientes con hipercalcemia mas pronunciada, el incremento del producto calcio-fosfato raramente llega a la calcificación de tejido metastásico. Aunque es probable que la excreción urinaria de calcio disminuya con esta terapia, es poco probable que se modifique el calcio plasmático. La terapia con fosfatos por vía oral también tienen efectos adversos tal como la diarrea.
La eficacia y seguridad del tratamiento con bifosfonatos para la terapia del hiperparatiroidismo primario todavía no son claras. Aunque se puede esperar una caída inicial en los niveles de calcio sérico los efectos a largo plazo son desconocidos. Esta paciente no requiere tratamiento con bifosfonatos para la osteoporosis. Según los resultados de la absorciometría con rayos X de energía dual, la masa ósea de esta paciente parece adecuada, lo que probablemente sea un reflejo de su terapia estrogénica.
Bibliografía:
1) Silverberg SJ, Bilezikian JP. Evaluation and management of primary hyperparathyroidism. J Clin Endocrinol Metab. 1996; 81: 2036-40
2) Strewler GJ. Indications for surgery in patients with minimally symptomatic primary hyperparathyroidism. Surg Clin North Am. 1995; 75: 439-47
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians
martes, 3 de febrero de 2009
Imágenes de la sala







Diagnóstico: metástasis de carcinoma indiferenciado.
Mejor respuesta
Cual de las siguientes enfermedades es la más probable que presente este paciente:
A) Hipertensión esencial con insuficiencia aórtica secundaria.
B) Coartación de la aorta y una válvula aórtica bicúspide.
C) Estenosis aórtica supravalvular más estenosis de la rama pulmonar.
D) Insuficiencia aórtica aislada.
E) Ductus arterioso persistente.
Respuesta correcta: B
Objetivo educacional: reconocer clínicamente la coartación aórtica.
La coartación de la aorta es una causa curable de hipertensión sistémica que se diagnostica clínicamente por la diferencia entre la presión sistólica de las extremidades superiores e inferiores, como en este paciente.
Normalmente, la presión sistólica en las extremidades inferiores, habitualmente excede la presión arterial en los brazos en 5 a 10 mmHg. En una estenosis aórtica supravalvular(más estenosis de una rama pulmonar= síndrome de Williams) hay comúnmente una diferencia entre las presiones arteriales sistólicas del brazo derecho e izquierdo de varios mm Hg, pero pequeña diferencia entre las extremidades superiores e inferiores.
En este paciente, el ruido de eyección aórtica, y el soplo diastólico sugieren una válvula bicúspide y la presencia de una regurgitación aórtica leve. La incidencia de una válvula aórtica bicúspide en pacientes con coartación varía entre el 10 y el 80%, y estos pacientes podrían tratarse con profilaxis antibiótica para la endocarditis. El diagnóstico se confirma por ecocardiograma con Doppler. Los diagnósticos alternativos pueden causar soplos sistólicos y diastólicos pero no producen hipertensión y los hallazgos de enfermedad de la válvula aórtica bicúspide.
Bibliografía:
1) Wren C, Oslizlok P, Bull C: Natural history of supravalvular aortic stenosis and pulmonary artery stenosis. Jam Coll Cardiol; 15: 1625-30
2) Cohen M , Fuster V, Steele PM, Driscoll D, Mc Goon DC, Coarctation of the aorta. Long term follow up and prediction of outcome after surgical correction. Circulation. 80: 840-5
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians

