Una mujer de 28 años de edad, fue vista en el
servicio de urgencias debido a dolor de cabeza, fiebre y erupción.
La paciente había estado bien hasta la mañana del
día del ingreso, cuando se despertó con un dolor de cabeza severo generalizado.
El dolor de cabeza empeoraba con el movimiento, no aliviaba con paracetamol o
ibuprofeno, y se acompañaba de náuseas, habiendo presentado un episodio de
vómitos biliosos. La paciente se volvió a dormir y se despertó de nuevo varias
horas más tarde con mialgias difusas; su temperatura era de 37,7 ° C. En ese
momento, también notó una erupción en el
abdomen, el pecho y el brazo derecho; las lesiones eran pequeñas, de color
rojo, planas, no pruriginosas, y no dolorosas. Describió estos síntomas a su
padre, un médico, quien le aconsejó que fuera al servicio de urgencias.
A la llegada al servicio de urgencias, la paciente
dijo que las náuseas se habían resuelto y que ahora presentaba rigidez en el
cuello.
Como antecedente, había padecido meningitis
bacteriana a los 9 años de edad, con síntomas similares a los de la enfermedad
actual. No tenía antecedentes de otitis media, sinusitis, neumonía o
infecciones de la piel. Refería un antecedente
remoto de hospitalización después de un accidente automovilístico. Diez
meses antes de la enfermedad actual, había tenido un episodio de litiasis renal
con eliminación espontánea de un cálculo. Ella también tenía antecedentes de
ansiedad. Tomaba citalopram y un anticonceptivo oral combinado con estrógeno y
progesterona. Su plan de vacunación estaba al día incluyendo vacunación contra
Neisseria meningitidis. Ella no tenía alergias conocidas. Vivía sola, trabajaba
como abogada, y no había viajado recientemente fuera de Nueva Inglaterra o
tenido contacto con personas enfermas. Ella tenía un novio reciente, pero no
era sexualmente activa. No fumaba ni usaba drogas ilícitas, y rara vez consumía
alcohol. Sus padres vivían cerca; ella había tenido contacto con sus dos
perros, pero no había tenido ninguna picaduras reciente de garrapata, picaduras
de mosquitos, o exposición a otros animales. No había antecedentes familiares
de inmunodeficiencia o de enfermedad autoinmune.
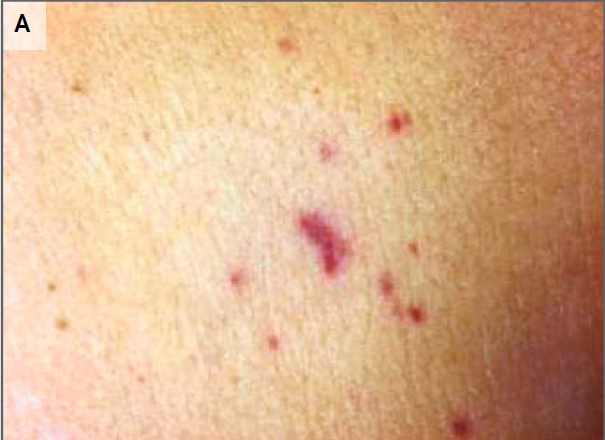
Figura 1. Fotografías del abdomen y el hombro.
Al ingreso había petequias en el abdomen de la
paciente (A), tórax y muslos. Una lesión ligeramente dolorosa purpúrica estaba
presente en el hombro derecho (B).
En el examen, la paciente estaba alerta y orientada
en persona, lugar y tiempo. La temperatura era de 37,3 ° C, el pulso de 92
latidos por minuto, la presión arterial 122/68 mm Hg, la frecuencia
respiratoria de 18 por minuto, y la saturación de oxígeno de 100% mientras
respiraba aire ambiente. Tenía petequias dispersas en el tórax, el abdomen y
los muslos y una lesión purpúrica en el hombro derecho que era dolorosa a la
palpación sin crepitación (Figura 1). El resto del examen era normal. El
hematocrito, concentración de hemoglobina, los índices de glóbulos rojos,
tiempo de protrombina, RIN, el nivel de ácido láctico, y los resultados de las
pruebas de función renal fueron normales, al igual que los niveles sanguíneos
de calcio, proteínas totales, albúmina, globulina, la alanina aminotransferasa,
aspartato aminotransferasa, fosfatasa alcalina, y lipasa; otros resultados del ensayo se
muestran en la Tabla 1. Los tests para virus de la gripe y el virus sincitial
respiratorio fueron negativos. El análisis de orina reveló orina amarilla,
ligeramente turbia, con trazas de cetonas y 1+ bilirrubina, sangre oculta,
albúmina y urobilinógeno; había 3 a 5 glóbulos blancos y de 5 a 10 glóbulos
rojos por campo de gran aumento, con 1+ bacterias, células de transición,
células tubulares renales, células escamosas, cristales amorfos y mucina.
Muestras de sangre y orina se obtuvieron para culltivo. Se le administró
lorazepam y se realizó una punción lumbar, después de lo cual se administró
ceftriaxona, vancomicina, aciclovir, y dexametasona por vía intravenosa.
Resultados del líquido cefalorraquídeo análisis se muestran en la Tabla 1.
Tabla 1. Datos de Laboratorio.
Dentro de los 90 minutos después de la llegada del
paciente al servicio de urgencias, la temperatura se elevó a 39,0 ° C y el
pulso se incrementó a 122 latidos por minuto. Durante las siguientes 3 horas,
se observaron nuevas petequias en tronco, brazos y piernas. Se administraron
líquidos intravenosos, acetaminofeno, ibuprofeno, metoclopramida, cloruro de
potasio, fosfato de potasio y fosfato de sodio. Se realizaron nuevas pruebas de
laboratorio; el tiempo y los niveles de fibrinógeno, haptoglobina, y lactato
deshidrogenasa-parcial de tromboplastina activada eran normales, y el nivel de
dímero D fue de 785 ng por mililitro (rango de referencia, <500 el="" en="" fue="" hospital.="" internada="" la="" o:p="" paciente="">
Durante el primer día de internación, el paciente
continuó presentando cefalea y se observó a tener rigidez de nuca leve, pero la
fiebre y la taquicardia resolvieron y las mialgias disminuyeron; el resto del
examen no presentaba cambios. Se realizaron nuevas pruebas de laboratorio cuyos
resultados se muestran en la Tabla 1. Ceftriaxona, vancomicina, aciclovir, y
dexametasona se continuaron. En el segundo día de hospital, se recibió un
resultado de la prueba de diagnóstico y se realizaron pruebas de diagnóstico
adicionales.
DIAGNÓSTICO DIFERENCIAL
Esta mujer de
28 años previamente sana se presentó con
dolor de cabeza intenso, náuseas, vómitos, mialgias y hallazgos en la piel. La
presencia de una erupción petequial evolucinó con nuevas lesiones en un período
de sólo unas pocas horas, lo que sugirió una enfermedad rápidamente progresiva
que requirió el reconocimiento y el tratamiento inmediato. Una línea de tiempo
de la presentación de este paciente destaca las características principales de
este caso (Figura 2) ; estos hallazgos
se identificaron únicamente a través de la historia clínica y el examen
físico, lo que subraya el papel crucial de las capacidades médicas y destrezas
diagnósticas al lado de la cama del paciente para detectar potenciales emergencias médicas.1,2
Figura 2 Síntomas y signos en menos de 24 horas.
El inicio de los síntomas y signos en menos de 24
horas en el primer día de enfermedad primero en su casa y después den el
departamento de emergencias muestra la rápida evolución de los hallazgos
clínicos demandando un rápido reconocimiento y manejo en el departamento de
emergencias por potencial emergencia médica.
SÍNDROME DE RESPUESTA INFLAMATORIA SISTÉMICA
En esta paciente parecen confluir tres procesos que expresan: una enfermedad sistémica con
manifestaciones que involucran la piel y el sistema nervioso central. En el
momento de la presentación al servicio de urgencias, el ritmo cardíaco de la
paciente fue superior a 90 latidos por minuto y su recuento de glóbulos blancos
era mayor que 12.000 por milímetro cúbico. Con la presencia de esos dos elementos,
la paciente tenía criterios para síndrome de respuesta inflamatoria sistémica
(SIRS) .3 Aunque existía trombocitopenia, no había evidencias manifiestas de
coagulación intravascular diseminada; el nivel de dímero D estaba sólo
ligeramente elevado y el nivel de fibrinógeno, el tiempo de protrombina, y el KPTT estaban normales. La hipopotasemia,
hipomagnesemia, hipofosfatemia y la hiponatremia, así como la presencia de
albúmina, glóbulos rojos y células tubulares renales en la orina también
plantean la posibilidad de sepsis.5-8
VASCULOPATÍA
El segundo proceso
evidente de enfermedad en este
paciente gira en torno a sus hallazgos de piel, petequias y una lesión purpúrica; estos
hallazgos sugieren una vasculopatía. Es quizás igualmente importante tener en
cuenta la ausencia de bullas, cambios gangrenosos, y crepitación, hallazgos que
sugerirían necrosis tisular o infarto
junto a la ausencia de púrpura generalizada, hallazgo que podría ser indicativo
de púrpura fulminante.9 La vasculopatía
en presencia de sepsis, o vasculopatía séptica, a menudo resulta en lesiones
purpúricas y pueden ser causadas por una variedad de organismos, incluyendo N.
meningitidis que da cuenta de aproximadamente la mitad de los casos entre
pacientes no inmunosuprimidos. 10 La
vasculopatía séptica puede ocurrir dentro de las 24 horas después del inicio de
la enfermedad como se observó en esta paciente, y la biopsia de una lesión
revela característicamente trombos de fibrina intravascular en los vasos superficiales y profundos de la
piel, algunos con necrosis fibrinoide.
10 Esos hallazgos pueden estar asociados con endotoxemia bacteriana.
MENINGITIS
Además de SIRS y vasculopatía, esta paciente tenía
meningitis aguda, como lo indica la aparición brusca de dolor de cabeza y pleocitosis
neutrofílica en el LCR. Los siguientes hallazgos clínicos que se asocian a
menudo con meningitis bacterianas estuvieron ausentes en este caso: cambios en el estado mental, un recuento de
neutrófilos en LCR de más de 1.000
células por milímetro cúbico, organismos visibles en la tinción de Gram,
hipoglucorraquia (un bajo nivel de glucosa en LCR) y una proteinorraquia
elevada. Sin embargo, es importante
reconocer que uno o más signos o síntomas clínicos o de laboratorio que son
típicos de la meningitis tales como fiebre, rigidez de nuca, alteración del
estado mental, y un recuento de células de mayor de 1000 por milímetro cúbico
en LCR pueden estar ausentes en un número considerable de pacientes con este
diagnóstico, y la glucosa en el LCR y
los niveles de proteína pueden ser normales.13,14 Del mismo modo, los adultos
con meningitis meningocócica, la alteración de la conciencia puede estar
ausente en 49% y la tinción de Gram en el LCR puede ser negativa para los
organismos en el 11% .15 Las anomalías del LCR relativamente leves en esta
paciente también pueden indicar que se presentó muy temprano en el curso de la
meningitis.16 Dada la amplia gama de presentaciones clínicas y de laboratorio
de los pacientes con meningitis bacteriana y la probabilidad de vasculopatía
séptica en este paciente, una causa de meningitis bacteriana sigue siendo el
diagnóstico más probable.
CAUSAS BACTERIANAS DE LA MENINGITIS
Streptococcus pneumoniae debe ser una consideración
seria en esta paciente, ya que es la causa más común de meningitis bacteriana
en adultos aunque es poco probable que se asocie con vasculopatía. Haemophilus influenzae es una causa muy poco frecuente de meningitis
bacteriana y vasculopatía en
adultos.10,18 Staphylococcus aureus puede estar asociados con bacteriemia y
vasculopatía, pero meningitis
y púrpura adquiridas en la comunidad
rara vez son causados por este microorganismo.19 La bacteriemia por N.
gonorrhoeae puede estar asociada con
vasculopatía, pero sería inusual para este organismo que causara meningitis20;
Asimismo, dada la supuesta falta de actividad sexual en este paciente, es poco
probable este diagnóstico.
Capnocytophaga Canimorsus es un bacilo gram-negativo asociado a la
exposición a perros. La infección por C.
canimorsus puede manifestarse por sepsis, vasculopatía, y meningitis, pero a
menudo se produce en presencia de asplenia asociada a mordedura de perros 21;
nada de esto eran un factores de riesgo evidentes en esta paciente. Aunque
Streptococcus pyogenes se ha asociado con meningitis y
vasculopatía, la meningitis estreptocócica por estreptococos del grupo A
usualmente ocurre en presencia de otitis media o sinusitis. Rickettsia rickettsii, el agente de la Fiebre
de las Montañas Rocosas, puede causar vasculopatía grave y en ocasiones
meningitis; Sin embargo, una erupción desarrollada dentro de las primeras 24
horas después de la aparición de la enfermedad en una paciente que no tenía
exposición reportada a picaduras de
garrapatas hacen que una infección causada por este organismo sea poco
probable. Ántrax debe estar en el diagnóstico diferencial de cualquier
enfermedad con inicio abrupto caracterizada por sepsis y vasculopatía, pero la ausencia de un curso de
la enfermedad fulminante asociada a shock y meningitis hemorrágica hace este
diagnóstico muy improbable.24 La bacteriemia por Kingella kingae, un bacilo
gram-negativo, puede estar asociada con signos y síntomas similares a los
observados en esta paciente; Sin embargo, la infección por K. kingae ocurre principalmente en niños y rara vez se
complica por meningitis.25 Otros bacilos gramnegativos, como Pseudomonas
aeruginosa, están también en el diagnóstico diferencial; es raro que P.
aeruginosa cause meningitis adquirida en
la comunidad, y cuando lo hace, por lo general afecta a pacientes con
enfermedades médicas crónicas de
base.
N. meningitidis se asocia con una enfermedad
rápidamente progresiva, a veces fulminante caracterizada por sepsis, petequias,
púrpura, y meningitis.27,28 Este organismo es la segunda causa más común de
meningitis bacteriana en los adultos, y la mayoría de los casos ocurren
esporádicamente.17 De los adultos con meningitis bacteriana y erupción simultánea, en las dos terceras
partes se concluye en un diagnóstico de enfermedad meningocócica y la mayoría
tienen rash petequial. De los adultos
con meningitis meningocócica, 49% busca atención médica antes de 24 horas
después de la aparición de los síntomas y el 64% tienen erupción, de los cuales
la mayoría tienen petequias y un cuarto de los casos tienen púrpura, equimosis
o ambas cosas 15; estas características son consistentes con la presentación
clínica de esta paciente. Aunque esta paciente había recibido la vacuna contra
N. meningitidis serogrupos A, C, Y y W-135, es posible que estuviese infectada con
otro serogrupo, como el serogrupo B, que representa el 50% de la enfermedad
meningocócica en los países desarrollados. 31
Muchos factores de riesgo comúnmente citados para la
enfermedad meningocócica como
hipogammaglobulinemia, lupus eritematoso sistémico, hipoesplenia funcional, y
asplenia parecen poco probables en esta
paciente porque ella no tiene antecedentes de otras infecciones recurrentes
piogénicas, condiciones médicas crónicas, o esplenectomía. Sin embargo, otros
factores de riesgo, incluyendo el virus de la inmunodeficiencia humana (VIH) y
la deficiencia del complemento, se deben descartar.32
OTRAS CAUSAS DE MENINGITIS
Aunque la enfermedad de esta paciente es más
consistente con un proceso bacteriano, otras causas de meningitis deben
considerarse en el diagnóstico diferencial. Infección por enterovirus puede
estar asociada con meningitis, a menudo con pleocitosis neutrofílica en el LCR
durante la fase temprana de la enfermedad, pero una erupción hemorrágica
simultánea en un adulto sería una forma muy inusual de presentación de
enfermedad viral. La enfermedad del
virus del Ébola, es poco probable, ya que la paciente no había viajado
recientemente a un área donde estas enfermedades son endémicas. Infecciones por
virus de Epstein-Barr y citomegalovirus agudos son también poco probables dada
la ausencia de niveles elevados de enzimas hepáticas y linfocitosis atípica.
Una infección aguda por parvovirus con meningitis asociada sería
muy inusual en ausencia de artropatía en una mujer adulta.35 La infección por el virus de la influenza en
ocasiones puede estar asociada con vasculopatía, pero raramente se asocia a meningitis.36 La
ausencia de síntomas respiratorios y la prueba rápida de diagnóstico negativo
para la influenza en este paciente hacen a este diagnóstico improbable.
Entre las causas no infecciosas, lupus eritematoso
sistémico y las meningitis provocadas por
drogas deben ser considerados. El lupus eritematoso sistémico puede
estar asociada con meningitis aséptica,
pero la meningitis rara vez es una manifestación inicial de LES. 37 Aunque el
ibuprofeno es una causa común de meningitis inducida por fármacos y con
frecuencia se asocia con pleocitosis neutrofílica en el LCR, pero fue tomado
por esta paciente después de la aparición de los síntomas y sólo rara vez se
asocia con petequias.
MENINGITIS RECURRENTE
¿Por qué esta paciente tiene un episodio de
meningitis cuando era niña y otra vez de adulto? Una deficiencia de la fracción
terminal del complemento implican los componentes C5, C6, C7, C8, C9 podrían explicar no sólo su mayor
susceptibilidad a la enfermedad meningocócica, sino también la naturaleza
relativamente leve de la enfermedad (caracterizada por la ausencia de
coagulación intravascular diseminada y púrpura fulminante ) y su rápida
recuperación.39,40 Además, una deficiencia en uno de los componentes terminales
del complemento, con la excepción de C9, se ha asociado con meningitis
meningocócicas recurrentes. Aunque la anterior meningitis bacteriana de esta
paciente, que ocurrió a los 9 años de edad, no se especifica en la historia
clínica, los síntomas parecen haber sido
similares a los de la enfermedad actual. Otras causas de la meningitis
bacteriana recurrente, como defectos anatómicos con fuga de LCR asociado, parecen poco probables,
ya que la paciente no tenía antecedentes reportados de otorrea o rhinorrhea.41
Del mismo modo, su buen estado de salud reportado durante los 19 años después
de su primer episodio de bacterias meningitis hacen que la otitis media y las
sinusitis crónica sean causas improbables de su meningitis bacteriana
recurrente.
Sobre la base de la presentación clínica y de
laboratorio de esta paciente y la epidemiología de cada causa posible,
meningococcemia con meningitis asociada es el diagnóstico más probable. Creo
que el resultado de la prueba diagnóstica fue un hemocultivo positivo para N.
meningitidis. Por otra parte, dado el carácter relativamente leve y recurrente
de la meningitis bacteriana del paciente, sospecho que ella tiene una
deficiencia hereditaria de la fracción terminal del complemento que afecta a C5, C6, C7, C8. Recomiendo la
prueba de anticuerpos para VIH. Pruebas diagnósticas adicionales, que deben
realizarse después de que el paciente se recupere de su enfermedad, deben
incluir un ensayo para la actividad total del complemento hemolítico (por
ejemplo, CH50) y, si ese resultado es bajo, entonces las pruebas de componentes
terminales del complemento individuales por separado. Si se confirma el
diagnóstico de deficiencia del complemento, la prueba también se debe ofrecer a
los familiares inmediatos del paciente. Finalmente, una vacuna contra N.
meningitidis serogrupo B ha sido recientemente aprobada y debe ser administrada a este paciente para
ayudar a minimizar su riesgo de enfermedad meningocócica futuro.
El
diagnóstico principal fue
meningitis bacteriana. Dado la erupción de la paciente y su historia de
un episodio previo de la meningitis, es que sospechábamos N. meningitidis
recurrente. La administración de vancomicina intravenosa, ceftriaxona y
aciclovir ya se había iniciado y que le habían dado una dosis de dexametasona
mientras ella estaba en el servicio de urgencias, por lo que se recomendó que
este régimen se continuara como la evaluación procedió. A través de la
discusión con el departamento de salud del estado, nos enteramos de que el
episodio de meningitis que se había producido en el paciente a los 9 años de
edad había sido debido a N. meningitidis del serogrupo B. Se sospechó
fuertemente un trastorno relacionado con el complemento y recomendamos la
consulta con un especialista en inmunología para ayudar a guiar la evaluación
de la presencia de la inmunodeficiencia. Debido a la sospecha de infección por
N. meningitidis, también recomendamos que los contactos cercanos del paciente
recibieran profilaxis con rifampicina oral.
DIAGNOSTICO CLÍNICO
MENINGITIS MENINGOCÓCICA RECURRENTE EN UNA PACIENTE CON DEFICIENCIA DE COMPLEMENTO.
DISCUSIÓN PATOLÓGICA
Se realizaron cultivos de dos muestras de sangre
obtenidas en el departamento de emergencia antes de la administración de
agentes antibióticos. Después de aproximadamente 24 horas de incubación en un
instrumento automático de hemocultivo, se detectó crecimiento en ambas botellas
aeróbicas. La tinción de Gram reveló diplococos gramnegativos con una forma de
granos de café intracelular y extracelular (Figura 3 ). El caldo de hemocultivo
se subcultivó en medios sólidos; después del crecimiento de colonias bacterianas,
el microorganismo fue identificado como N. meningitidis. En las pruebas in
vitro revelaron la susceptibilidad del microorganismo tanto a penicilina y
ceftriaxona. El laboratorio de microbiología clínica también recibió una
muestra de LCR; Tinción de Gram reveló numerosos neutrófilos, pero no se
observaron microorganismos y los cultivos fueron negativos.
FIGURA 3 Estudio microbiológico.
Tinción de Gram en hemocultivos que muestran
diplococos gramnegativos intracelulares con forma de granos de café (flechas),
hallazgo característico de Neisseria meningitidis.
Dado que este fue el segundo episodio de la
enfermedad meningocócica invasiva del paciente, se realizó la evaluación de
laboratorio de la inmunodeficiencia. Se midieron los títulos de anticuerpos IgG
contra antígeno polisacárido neumocócico capsular y toxoide tetánico y no sugirieron anormalidades de la función de células B o
bien de células T-independiente. Los niveles de anticuerpos IgG, IgA, e IgM
fueron normales, así como el patrón de electroforesis de proteínas séricas. Sin
embargo, los ensayos tanto de la actividad total del complemento hemolítico
(CH50) y la actividad de la vía alternativa del complemento (AH50) tuvieron
resultados anormalmente bajos; el nivel de CH50 fue de menos de 3 U por
mililitro (rango de referencia, 63-145), y el nivel AH50 era 12% de lo normal
(intervalo de referencia, el 75 a 170). Los niveles de C3, C4, y el factor B
fueron normales. Las tres vías del sistema del complemento (es decir, la vía
clásica, la vía de la lectina de unión a manano, y la vía alternativa)
convergen en la activación de C3 de sus respectivas convertasas C3, y por lo
tanto la observación de un nivel de CH50 baja en un paciente con un nivel de C3
normal indica que la deficiencia se localiza aguas abajo de este punto de
convergencia. El nivel AH50 bajo, junto con el bajo nivel de CH50 y los niveles
normales de C3, C4, y el factor B, sugiere una deficiencia en uno de los
componentes terminales del complemento (C5, C6, C7, C8, C9) . La evaluación de
los componentes terminales del complemento individualmente reveló una
deficiencia en C8 (nivel C8, 13 U por mililitro; intervalo de referencia, de 33
a 58).
La deficiencia de C8 confiere un riesgo
sustancialmente elevado de infección invasiva por N. meningitidis.44 Aunque una bacteriemia
meningocócica transitoria de bajo grado se puede superar mediante la
opsonización y fagocitosis posterior,
las bacteriemias más importantes o
persistentes requieren del sistema del complemento para la erradicación. La
vacunación se realiza en un intento de aumentar la respuesta temprana
opsoninofagocítica.45 Finalmente sin embargo, una respuesta suficiente e
intacta de los componentes terminales del complemento son cruciales en los
mecanismos de defensa contra los microorganismos de abrumador crecimiento y en
la protección contra la enfermedad invasiva.
Una vez que supimos que los hemocultivos fueron
positivos para N. meningitidis, se recomendó un tratamiento de 7 días con
ceftriaxona intravenosa. Durante este tiempo, la paciente resolvió el cuadro
completamente.
Posteriormente se le administró la vacuna
tetravalente conjugada antimeningocócica, la vacuna neumocócica conjugada
13-valente y la vacuna de H. influenzae tipo B. También se le recetó un
antibiótico oral para uso de emergencia en caso de que ella tuviese
síntomas recurrentes de meningitis en un momento en que ella tenga
acceso limitado a la atención médica.
La paciente
fue vista de nuevo 5 meses más tarde y recibió una segunda dosis de la vacuna
antimeningocócica conjugada tetravalente. En ese momento, ella sabe que tienen una deficiencia de C8
aislado. El riesgo de infección por N. meningitidis entre las personas con una
deficiencia del complemento terminal es de 7000 a 10.000 veces mayor que el
riesgo entre las personas sin tal deficiencia; Además, aproximadamente el 50%
de las personas con una deficiencia de la fracción terminal del
complemento que han tenido infección N.
meningitidis tienen infecciones recurrentes. Sin embargo, la infección por N. meningitidis
infección suele ser más leve y se asocia con una menor mortalidad entre las
personas con una deficiencia terminal del complemento que entre las personas
sin la deficiencia.40 Pensamos que esta
paciente se beneficiaría con la inmunización con la vacuna contra N.
meningitidis del serogrupo B. Se estaba disponible en los Estados Unidos en el
momento, pero el paciente perseguido con éxito la vacunación en Canadá. Por
último, sus familiares inmediatos se ofrecieron para realizarse pruebas para
deficiencia del complemento, y su hermana también fue identificado como
padeciendo una deficiencia C8.
DIAGNOSTICO FINAL
INFECCIÓN POR NEISSERIA MENINGITIDIS INVASIVA Y DEFICIENCIA PRIMARIA DE C8.
Fuente: "A 28-Year-Old Woman with Headache, Fever, and a Rash"
Farrin A.
Manian, M.D., and Diana Alame, M.D.
The New England of Medicine.
The New England of Medicine.
1. Block SL.
Petechiae and purpura: the
ominous and the
not-so-obvious? Pediatr
Ann 2014; 43:
297-303.
2. McQueen A,
Martin SA, Lio PA. Derm
emergencies:
detecting early signs of
trouble. J Fam
Pract 2012; 61: 71-8.
3. Bone RC, Balk
RA, Cerra FB, et al. Definitions
for sepsis and
organ failure and
guidelines for
the use of innovative therapies
in sepsis. Chest
1992; 101: 1644-55.
4. Taylor FBJ
Jr, Toh CH, Hoots WK,
Wada H, Levi M.
Towards definition, clinical
and laboratory
criteria, and a scoring
system for
disseminated intravascular coagulation.
Thromb Haemost
2001; 86:
1327-30.
5. Akil I,
Yüksel H, Coskun S, Yilmaz D,
Onag A.
Fulminant meningococcemia
and acute renal
failure in a 3-year-old boy.
Pediatr Nephrol
2004; 19: 237-9.
6. Barak V,
Schwartz A, Kalickman I,
Nisman B, Gurman
G, Shoenfeld Y. Prevalence
of
hypophosphatemia in sepsis
and infection:
the role of cytokines. Am J
Med 1998; 104:
40-7.
7. Pollard AJ,
Britto J, Nadel S, DeMunter
C, Habibi P,
Levin M. Emergency management
of meningococcal
disease. Arch Dis
Child 1999; 80:
290-6.
8. Simerville JA, Maxted WC, Pahira JJ.
Urinalysis: a
comprehensive review. Am
Fam Physician
2005; 71: 1153-62.
9. Betrosian AP,
Berlet T, Agarwal B.
Purpura
fulminans in sepsis. Am J Med
Sci 2006; 332: 339-45.
10. Delgado-Jiménez Y, Fraga J, Requena
C, et al. Acute
bacterial septic vasculopathy.
Int J Dermatol
2013; 52: 1071-80.
11. Feigin RD,
Shackelford PG. Value of
repeat lumbar
puncture in the differential
diagnosis of
meningitis. N Engl J Med
1973; 289: 571-4.
12. Seehusen DA, Reeves MM, Fomin DA.
Cerebrospinal
fluid analysis. Am Fam
Physician 2003;
68: 1103-8.
13. van de Beek D, de Gans J, Spanjaard L,
Weisfelt M,
Reitsma JB, Vermeulen M.
Clinical
features and prognostic factors
in adults with
bacterial meningitis.
N Engl J Med
2004; 351: 1849-59.
14. Durand ML,
Calderwood SB, Weber
DJ, et al. Acute
bacterial meningitis in
adults: a review
of 493 episodes. N Engl J
Med 1993; 328:
21-8.
15. Heckenberg
SG, de Gans J, Brouwer
MC, et al.
Clinical features, outcome, and
meningococcal
genotype in 258 adults
with
meningococcal meningitis: a prospective
cohort study.
Medicine (Baltimore)
2008; 87:
185-92.
16. Geiseler PJ,
Nelson KE. Bacterial
meningitis
without clinical signs of meningeal
irritation.
South Med J 1982; 75:
448-50.
17. Thigpen MC,
Whitney CG, Messonnier
NE, et al.
Bacterial meningitis in the
United States,
1998–2007. N Engl J Med
2011; 364:
2016-25.
18. Endo A,
Shiraishi A, Aiboshi J, Hayashi
Y, Otomo Y. A
case of purpura fulminans
caused by
Hemophilus influenzae
complicated by
reversible cardiomyopathy.
J Intensive Care
2014; 2: 13.
19. Chambers HF.
Staphylococcal purpura
fulminans: a
toxin-mediated disease?
Clin Infect Dis
2005; 40: 948-50.
20. Mofredj A,
Baraka D, Madec Y, Lemaitre
P. Disseminated
gonococcal infection
and meningitis.
Am J Med 2000; 109: 71-2.
21. Kullberg BJ,
Westendorp RG, van ’t
Wout JW,
Meinders AE. Purpura fulminans
and symmetrical
peripheral gangrene
caused by
Capnocytophaga canimorsus
(formerly DF-2)
septicemia — a
complication of
dog bite. Medicine (Baltimore)
1991; 70:
287-92.
22. Steppberger
K, Adams I, Deutscher J,
Müller H, Kiess
W. Meningitis in a girl
with recurrent
otitis media caused by
Streptococcus
pyogenes — otitis media
has to be
treated appropriately. Infection
2001; 29: 286-8.
23. Massey EW,
Thames T, Coffey CE,
Gallis HA.
Neurologic complications of
Rocky Mountain
spotted fever. South Med
J 1985; 78:
1288-90.
24. Dixon TC,
Meselson M, Guillemin J,
Hanna PC.
Anthrax. N Engl J Med 1999;
341: 815-26.
25. Yagupsky P,
Porsch E, St Geme JW III.
Kingella kingae:
an emerging pathogen in
young children.
Pediatrics 2011; 127: 557-65.
26. Huang CR, Lu
CH, Chuang YC, et al.
Adult
Pseudomonas aeruginosa meningitis:
high incidence
of underlying medical
and/or
postneurosurgical conditions and
high mortality
rate. Jpn J Infect Dis 2007;
60: 397-9.
27. Guarner J,
Greer PW, Whitney A, et al.
Pathogenesis and
diagnosis of human
meningococcal
disease using immunohistochemical
and PCR assays.
Am J Clin
Pathol 2004; 122: 754-64.
28. Stephens DS.
Uncloaking the menin-disease.
Lancet 1999;
353: 941-2.
29. Centers for
Disease Control and Prevention.
Meningococcal
disease: technical
and clinical
information. 2014 (http://
www .cdc .gov/
meningococcal/ clinical
-info .html).
30. Rosenstein
NE, Perkins BA, Stephens
DS, Popovic T,
Hughes JM. Meningococcal
disease. N Engl
J Med 2001; 344: 1378-
88.
31. Stephens DS.
Outer-membrane-vesicle
vaccines: old
but not forgotten. Lancet
Infect Dis 2011;
11: 421-2.
32. Stephens DS,
Greenwood B, Brandtzaeg
P. Epidemic
meningitis, meningococcaemia,
and Neisseria
meningitidis.
Lancet 2007;
369: 2196-210.
33. Ihekwaba UK,
Kudesia G, McKendrick
MW. Clinical
features of viral meningitis
in adults:
significant differences in
cerebrospinal
fluid findings among herpes
simplex virus, varicella zoster virus,
and enterovirus
infections. Clin Infect Dis
2008; 47: 783-9.
34. Taylor GH.
Cytomegalovirus. Am Fam
Physician 2003;
67: 519-24.
35. Heegaard ED,
Brown KE. Human parvovirus
B19. Clin
Microbiol Rev 2002; 15:
485-505.
36. Glaser CA,
Winter K, DuBray K, et al.
A
population-based study of neurologic
manifestations
of severe influenza
A(H1N1)pdm09 in
California. Clin Infect
Dis 2012; 55:
514-20.
37. Kim M, Kim
DG, Koo YH, et al. A case
of systemic
lupus erythematosus presenting
as aseptic
meningitis. J Neurocrit
Care 2008; 1:
62-4.
38. Rodríguez
SC, Olguín AM, Miralles
CP, Viladrich
PF. Characteristics of meningitis
caused by
Ibuprofen: report of 2
cases with
recurrent episodes and review
of the
literature. Medicine (Baltimore)
2006; 85:
214-20.
39. Densen P.
Complement. In: Mandell
GL, Bennett JE,
Dolin R, eds. Mandell,
Douglas, and
Bennett’s principles and
practice of
infectious diseases. 7th ed.
Philadelphia:
Churchill Livingstone Elsevier,
2010: 77-98.
40. Ram SLL,
Lewis LA, Rice PA. Infections
of people with
complement deficiencies
and patients who
have undergone
splenectomy.
Clin Microbiol Rev 2010; 23:
740-80.
41. Tebruegge M,
Curtis N. Epidemiology,
etiology,
pathogenesis, and diagnosis
of recurrent
bacterial meningitis. Clin Microbiol
Rev 2008; 21:
519-37.
42. Food and
Drug Administration. First
vaccine approved
by FDA to prevent serogroup
B Meningococcal
disease. 2014
(http://www .fda
.gov/ NewsEvents/
Newsroom/
PressAnnouncements/
ucm420998 .htm).
43. Centers for
Disease Control and Prevention.
Chapter 10: PCR
for detection
and
characterization of bacterial meningitis
pathogens. 2012
(http://www .cdc
.gov/
meningitis/ lab-manual/ chpt10-pcr
.html.)
44. Bennett JE,
Dolin R, Blaser MJ, eds.
Mandell,
Douglas, and Bennett’s principles
and practice of
infectious diseases.
8th ed.
Philadelphia: Elsevier Saunders,
2014.
45. Lewis LA,
Ram S. Meningococcal disease
and the
complement system. Virulence
2014; 5: 98-126.