Espacio virtual creado para discutir casos clínicos, actualizar temas y comentar inquietudes relacionadas con la práctica de la Medicina Interna
jueves, 11 de junio de 2009
Paciente de 80 años con lumbalgia.
Un hombre de 80 años con osteoartrosis de ambas caderas y columna, comenzó con dorsalgia y empeoramiento del dolor en cadera izquierda. El dolor comenzó súbitamente, sin trauma previo, no se irradiaba, y no aliviaba con ninguna posición. La dorsalgia persistió por 2 semanas a pesar de reposo e ibuprofen. El paciente no tomaba ninguna medicación.
Una dorsalgia a los 80 años, hace sospechar osteoporosis, primaria o secundaria. El área medio torácica es un sitio común de fracturas por compresión. Aunque la osteoporosis es más frecuente en las mujeres que en los hombres, a esta edad, los hombres también suelen padecerla con frecuencia. La osteoporosis con fracturas por compresión es el diagnóstico más probable en este contexto, así que yo obtendría algún estudio de imágenes. El paciente puede también tener cáncer metastático. Quisiera saber también si el dolor lo despierta de noche, o si tiene algún otro síntoma de alarma, las llamadas “banderas rojas”. La osteoartritis de columna lumbar también puede cursar con dolor inespecífico.
Como antecedentes, el paciente tiene una historia de resección de colon hace 10 años por un adenoma velloso, y tiene una hipertrofia prostática benigna, con un PSA de 5,6 mg/ml y una biopsia de próstata negativa hace 2 años. La temperatura, el pulso, y la presión arterial son normales, así como el examen cardiovascular y pulmonar. No duele la columna a la palpación, pero hay dolor en los músculos paraespinales a nivel de D7. La maniobra de Lasegue no empeora el dolor. El paciente tiene fuerza conservada en miembros inferiores así como la sensibilidad y los reflejos osteotendinosos. Las radiografías de columna dorsal revelan marcados cambios degenerativos desde D1 hasta D6 con osteofitos posteriores.
El paciente tiene una historia de neoplasia de colon. Es inusual para el cáncer de colon que dé metástasis a columna, aunque es posible. Las radiografías son esencialmente negativas, hallazgo que efectivamente descarta una fractura por compresión.
El clínico prescribió acetaminofen con codeína. El paciente volvió tres semanas después con empeoramiento del dolor, que se había migrado desde la columna dorsal. El tenía que dormir sentado debido a que el dolor empeoraba en decúbito dorsal. No tenía síntomas vesicales, rectales ni radiculares; no tenía fiebre, escalofríos, sudoración nocturna, pérdida de peso, o dolor en otro lado. Su glándula prostática estaba agrandada, simétrica y no tenía nódulos. El recuento de glóbulos blancos era de 9400/mm3, con 70% de granulocitos, 14% de linfocitos, 4% de monocitos, 2% de eosinófilos. Otros valores de laboratorio mostraban: hemoglobina 12,5 g/dl; VCM 95um3, PSA 8,9 ng/ml, y eritrosedimentación de 112 mm/hora. Las enzimas hepáticas eran normales, como lo era el análisis de orina y la electroforesis de proteínas séricas; un test para sangre oculta en materia fecal fue negativo
El paciente tiene un persistente y marcado dolor que empeora cuando está acostado. Me preocupa la probabilidad de metástasis epidurales. El PSA es elevado una bandera roja en pacientes de esta edad. Las lesiones metastásicas de cáncer de próstata son usualmente osteoblásticas, y sus radiografías son negativas para metástasis. La eritrosedimentación elevada es preocupante, y me hace preocupar acerca infección crónica, tumor metastático, vasculitis, o mieloma múltiple. El paciente no tiene síntomas constitucionales que sugieran la presencia de infección o vasculitis. EL mieloma múltiple es improbable dados los resultados normales de la orina y de la electroforesis sérica.
Las radiografías de cadera y de columna lumbar mostraron cambios degenerativos. Un centelleograma óseo mostró hipercaptación del trazador en los hombros, la unión cérvico- torácica y en las vértebras L4 y L5. Una TAC de columna mostró una severa estenosis espinal a nivel de L3 y L4, con pedículos cortos, y abombamiento asimétrico del disco, asociado a hipertrofia del ligamento amarillo. El saco dural estaba comprimido y desplazado posteriormente por tejido blando que se extendía desde la mitad del cuerpo de la vértebra L4 hasta la mitad del cuerpo de L5. El radiólogo consideró que el tejido blando probablemente estaba constituido por un disco herniado. El paciente recibió sulfato de morfina oral para controlar el dolor.
El paciente tiene una estenosis del canal espinal en la TAC, pero no tiene claudicación neurológica o pseudoclaudicación. Los hallazgos de la TAC son muy comunes en imágenes de columna, aún en pacientes que están asintomáticos. Los clínicos necesitan cotejar los hallazgos de las imágenes con los síntomas. El paciente tiene una masa de tejidos blandos interpretada como hernia de disco. Las hernias de disco son infrecuentes a esta edad; ellas ocurren comúnmente en pacientes de 30 a 55 años de edad. Cuando una hernia de disco ocurre en un paciente mayor, estas son generalmente en niveles más altos de la columna lumbar. Yo estoy más preocupado en este momento por esa anormalidad de tejidos blandos que puede representar una metástasis extradural más que una hernia de disco.
No me queda muy claro el resultado del centelleograma óseo, pero los cambios observados en los hombros y la región cérvico-torácica están relacionados con cambios degenerativos. La lesión a nivel de L4 a L5 probablemente represente una reacción a la masa de tejidos blandos. La masa puede ser un linfoma primario extendiéndose al espacio epidural.
Tres semanas después, el paciente se sometió a laminectomía descompresiva. Los estudios de laboratorio preoperatorios revelaron un recuento de glóbulos blancos de 8300/mm3, una hemoglobina de 11,1 g/dl, un recuento de plaquetas de 267000/mm, nivel normal de electrolitos séricos, función renal normal, y estudios normales de coagulación. En la cirugía, el cirujano encontró una marcada estenosis a nivel de L4, con hipertrofia del ligamento amarillo y abombamiento central del disco L4-L5. El examen anatomopatológico del material escindido, enviado de rutina reveló múltiples fragmentos de hueso y cartílago fibroso. No se llevaron a cabo estudios especiales.
El paciente fue sometido a cirugía espinal descompresiva. Yo asumo que si hubiese habido tumor, el cirujano o el patólogo lo hubieran reconocido. Quizás el paciente tenga una forma atípica de presentación de estenosis espinal, pero me sigue preocupando la posibilidad de otro proceso de base que se haya pasado por alto. Dada la presentación clínica, creo que no lo hubiese operado; Yo hubiera llevado a cabo una biopsia con aguja para descartar tumor o infección.
Un mes después de la cirugía, el paciente seguía requiriendo narcóticos para su lumbalgia. Posteriormente a eso, el paciente resbaló y cayó golpeando su región lumbar, con lo cuál su sintomatología dolorosa empeoró. El examen físico siguió sin cambios. Él tenía una hemoglobina de 10,6 g/dl y una eritrosedimentación persistentemente elevada de 104 mm/hora.
Cuál es el diagnóstico?
El paciente todavía tiene lumbalgia con profundización de su anemia y elevación de la eritrosedimentación. Creo que el diagnóstico correcto todavía no se ha hecho, y creo que probablemente tenga infección crónica, linfoma o cáncer metastático.
Las Rx mostraron alteración de la cara inferior de la vértebra L4, y el borde superior de L5, con colapso asociado (aplastamiento). En forma retrospectiva se observaron las Rx de un mes antes que ya mostraban una alteración de los bordes vertebrales. Una biopsia espirativa con aguja fina del disco L4-L5 mostró un líquido turbio con características serohemáticas. La coloración de Gram mostró numerosos leucocitos, pero no microorganismos. El examen citológico no mostró células neoplásicas. En el cultivo del líquido desarrolló Staphylococcus epidermidis. Dos muestras de hemocultivos y un urocultivo fueron negativos.
La destrucción de los bordes vertebrales y el hallazgo de leucocitos en la biopsia sugieren la presencia de infección en el espacio discal; no hay evidencia de cáncer. Los pacientes añosos pueden tener infección crónica sin evidencias de fiebre o leucocitosis. El paciente no tuvo absceso epidural en la cirugía, pero el hallazgo de dolor lumbar no-mecánico, y eritrosedimentación acelerada, así como la anemia asociada son consistentes con la presencia de infección subaguda o crónica. No estoy seguro si S epidermidis es el patógeno causal o es un contaminante.
El paciente recibió 6 semanas de vancomicina intravenosa. En los meses siguientes su lumbalgia se resolvió, su eritrosedimentación bajó a 20 mm/hora, y las Rx de la columna mostraron mejoramiento gradual.
El mejoramiento de los síntomas y la normalización de la eritrosedimentación con los antibióticos confirman la sospecha de que la infección fue la causa del problema.
Comentario:
La lumbalgia es un trastorno muy común, segundo en frecuencia después de las infecciones del tracto respiratorio superior como causa de consulta en la visita clínica. Generalmente es causada por causas músculoesqueleticas, y raramente secundaria a enfermedades específicas o lesiones patológicas. (1) Ocasionalmente, sin embargo, la lumbalgia es causada por un trastorno sistémico serio como cáncer o infección. Para evitar caer en errores diagnósticos, sin caer en sobreestudiar a todos los pacientes que no ameritan hacerlo, se debe poner gran atención en las pistas que orientan a enfermedad sistémica de base. Las anormalidades anatómicas en los estudios de imágenes son comunes, aún en personas asintomáticas, y tales anormalidades deben ser meticulosamente correlacionadas con la clínica del paciente para evitar juicios erróneos. (2)
Un approach probabilístico para la toma de decisiones en pacientes con lumbalgia puede ser de gran ayuda. Los indicadores de alto riesgo o "luces rojas", incluyen una edad de más de 50 años, antecedentes de cáncer, pérdida de peso inexplicada, dolor que dura más de 1 mes, ausencia de respuesta a la terapia, dolor que empeora en reposo, antecedentes de uso de drogas por vía endovenosa, y la presencia de infección del tracto urinario. (3) La presencia de las llamadas “luces rojas” pueden ayudar al clínico a identificar un subgrupo de pacientes con aumento de la probabilidad de tener enfermedades de base serias como causa de su lumbalgia. Wipf y Deyo han estimado que los pacientes con lumbalgia y una o más “luces rojas”, tienen una probabilidad de pretest de tener una enfermedad sistémica seria de más de 10%. (1) Cuando la probabilidad de pretest es alta, solo un resultado negativo de un test muy sensible disminuirá la probabilidad lo suficientemente como para descartar el diagnóstico de enfermedad sistémica.
La infección espinal (osteomielitis, o discitis), que este paciente tuvo, se presenta habitualmente como un desafío diagnóstico. Es una causa rara de dolor lumbar, dando cuenta de de menos del 0,01% de los casos en un contexto de consultorio de medicina general. (4) Para pensar en este diagnóstico, los clínicos no deben deben esperar los signos o síntomas de una infección.
La fiebre y la leucocitosis son hallazgos específicos pero completamente insensibles para la osteomielitis vertebral. Deyo (4) estimó que la fiebre está presente en el 52% de los pacientes con osteomielitis piogénica y sólo en 4% de las discitis.
La especificidad estimada de la fiebre para la osteomielitis en pacientes con lumbalgia es de 98%. (5) Por lo tanto, la presencia de fiebre aumenta el odds de infección espinal por un factor de 26; más importante en este paciente afebril, la ausencia de fiebre, reduce el odds sólo a la mitad. En forma similar, la leucocitosis (un recuento de blancos menor de 12000/mm3) está presente en alrededor de 43% de los pacientes con infección espinal y 6% de pacientes con lumbalgia de causas mecánicas y sin infección. (4,5) La presencia de un recuento de blancos por lo tanto, aumenta el odds de infección espinal por un factor de 7, pero un valor normal de blóbulos blancos disminuye el odds a 0,59 del odds inicial. Así, aunque la presencia de fiebre y leucocitosis aumenta en forma impresionante el odds de infección espinal, la ausencia de ambos no lo disminuye sustancialmente.
En este paciente, quien tenía una relativamente alta probabilidad de que su dolor lumbar obedeciera a causas sistémicas, la ausencia de fiebre y leucocitosis es escasa evidencia en contra del diagnóstico de infección espinal.
Los cambios radiográficos típicos, y una aspiración con aguja fina de material purulento conteniendo estafilococos confirmaría el diagnóstico en este paciente. La mayoría de las infecciones espinales son causadas por S aureus, y alrededor de un tercio son debidas a bacilos aeróbicos gram-negativos y son a menudo encontrados en pacientes con infecciones del tracto urinario. (6) S epidermidis está más típicamente asociado a infección posoperatoria de disco; en una gran serie, sin embargo, este organismo fue aislado en 16% de los pacientes con infecciones espinales espontáneas. (7) Más aún, en este caso, dado que ya había signos de infección espinal en las radiografías intraoperatorias, nosotros podemos excluir la posibilidad de que la infección fuese adquirida durante la cirugía.
El médico que discutió el caso identificó varias pistas de causa sistémica seria para esta lumbalgia. La persistencia del dolor en todas las posiciones, el hecho de que el dolor empeoraba cuando el paciente estaba acostado, la escasa respuesta a la terapia conservadora, y la elevación extrema de la eritrosedimentación lo hicieron preocupar sobre la posibilidad de cáncer o infección. Su preocupación persistió a pesar de los hallazgos de estenosis espinal y hernia de disco en la TAC, debido a que esos diagnósticos no explicaban todos los síntomas del caso.
La ciática ocurre en la mayoría de los pacientes con hernia de disco intervertebral, con una sensibilidad estimada de 95% y una especificidad de 88%. (8) La ausencia de ciática es una fuerte evidencia contra el diagnóstico de hernia de disco.
Historicamente, la claudicación neurogénica (dolor en piernas al caminar, que se resuelve con reposo, flexión lumbar, o ambos) es el marcador de la estenosis espinal del canal central, mientras que los pacientes con estenosis del receso lateral a menudo tienen dolor radicular. La claudicación neurogénica tiene una sensibilidad reportada de 60% para la estenosis del canal, mientras que el dolor en piernas tiene una sensibilidad de 85%(8)
La ausencia de síntomas en las piernas en este paciente reduce el odds para hernia de disco o estenosis espinal, aún aunque esas anormalidades anatómicas estuvieran presentes. La caracterización de la localización del dolor lumbar (que en este paciente se irradiaba desde la región torácica a la lumbar) tiende a ser impreciso y, con excepción de las radiculopatías y quizás las fracturas por aplastamiento vertebral, usualmente no son útiles en identificar la causa del dolor.
Uno de los más importantes hallazgos que excede al diagnóstico de estenosis espinal era la extremadamente elevada eritrosedimentación.
La eritrosedimentación puede dar importantes pistas hacia la presencia de enfermedades serias de base, (9) pero parece haber sido ignorada en este caso. La eritrosedimentación es a menudo considerada demasiado inespecífica para ser utilizada en el diagnóstico diferencial, pero es en realidad de gran ayuda en casos de pacientes con una probabilidad de pretest aumentada de tumor u osteomielitis vertebral. Cuando se compara con eritrosedimentaciones menores, una eritrosedimentación de más de 100 está asociada a un likelihood ratio de 55 para una causa seria de lumbalgia. (5)
En este paciente añoso con dolor continuo que empeoraba con la posición de acostado en decúbito dorsal, la probabilidad de pretest de una enfermedad sistémica seria es estimada ser alrededor de 10% (odds de pretest). (1) Su extremadamente alta eritrosedimentación multiplica el odds para enfermedad sistémica por un factor de 55, lo que dá un odds de 6:1, o una probabilidad de pretest de 85%!!!
Dado la posibilidad tan alta, era correcto que el médico que discutió el caso, siguiera preocupado, aún después de saber que el paciente padecía una estenosis espinal.
En conclusión podemos considerar varios puntos en este caso:
Primero, cuando evaluamos un paciente con síntomas de lumbalgia, los clínicos debemos estar alertas a las "luces rojas" que pueden indicar una causa seria del dolor.
Segundo, aunque la eritrosedimentación es generalmente un test inespecífico, los valores extremos son de gran valor, ya que valores de más de 100 en un paciente con dolor atípico aumenta sustancialmente el riesgo de cáncer u osteomielitis vertebral.
Finalmente, la elección de un test diagnóstico y la interpretación de los resultados debe reflejar el pensamiento clínico. La TAC es muy útil para evaluar pacientes cuyos síntomas son fuertemente sugestivos de hernia de disco o estenosis del canal espinal. Sin embargo, tanto la TAC como la RMN tienen una tasa de aproximadamente 20% de falsos positivos en pacientes con estenosis espinal. (10) Para evitar errores clínicos, las anormalidades en las imágenes deben ser correlacionadas con los síntomas de los pacientes.
Traducción de:
"A Pain in the Back"
Jon D. Lurie, M.D., Paul D. Gerber, M.D., and Harold C. Sox, M.D.
Clinical problem-solving
The New Englan Journal of Medicine
Volume 343:723-726. September 7, 2000. Number 10
Supported in part by a grant (AR4544401) from the National Institute of Arthritis and Musculoskeletal and Skin Diseases.
We are indebted to James N. Weinstein, D.O., for his excellent discussion of the case and helpful review of the manuscript.
Source Information
From the Department of Medicine, Dartmouth Medical School, Hanover, N.H.
Address reprint requests to Dr. Lurie at SPORT at the Spine Center, Dartmouth Hitchcock Medical Center, 1 Medical Center Dr., Lebanon, NH 03756, or at jon.d.lurie{at}dartmouth.edu .
References
1) Wipf JE, Deyo RA. Low back pain. Med Clin North Am 1995;79:231-246.[Medline]
2) Boden SD. Diagnostic imaging of the spine. In: Weinstein JN, Rydevik BL, Sonntag VKH, eds. Essentials of the spine. New York: Raven Press, 1995:97-110.
3) Bigos S, Bowyer O, Braen G, et al. Acute low back problems in adults. Clinical practice guideline no. 14. Rockville, Md.: Agency for Health Care Policy and Research, 1994:iii, 1-26. (AHCPR publication no. 95-0642.)
4) Deyo RA. Early diagnostic evaluation of low back pain. J Gen Intern Med 1986;1:328-338.[Medline]
5) Deyo RA, Diehl AK. Cancer as a cause of back pain: frequency, clinical presentation, and diagnostic strategies. J Gen Intern Med 1988;3:230-238.[Medline]
6) Sapico FL, Montgomerie JZ. Vertebral osteomyelitis. Infect Dis Clin North Am 1990;4:539-550.[Medline]
7) Carragee EJ. Pyogenic vertebral osteomyelitis. J Bone Joint Surg Am 1997;79:874-880. [Abstract/Full Text]
8) Deyo RA, Rainville J, Kent DL. What can the history and physical examination tell us about low back pain? JAMA 1992;268:760-765. [Full Text]
9) Sox HC Jr, Liang MH. The erythrocyte sedimentation rate: guidelines for rational use. Ann Intern Med 1986;104:515-523.[Medline]
10) Kent DL, Haynor DR, Larson EB, Deyo RA. Diagnosis of lumbar spinal stenosis in adults: a metaanalysis of the accuracy of CT, MR, and myelography. AJR Am J Roentgenol 1992;158:1135-1144.[Abstract]
martes, 9 de junio de 2009
Mejor respuesta.
El examen físico no reveló signos de traumatismo. Ella está afebril, con una frecuencia del pulso de 92 por minuto, una frecuencia respiratoria de 22 por minuto, y una presión arterial de 130/86 mmHg. Los pares craneales están normales incluyendo las respuestas pupilares a la luz. Su cuello es resitente a la flexión hacia delante. El tórax está limpio y los ruidos cardíacos son normales sin la presencia de soplos. Responde al dolor retirando el miembro. El tono muscular es igual en las cuatro extremidades. Todos los reflejos están presentes y son simétricos. Tiene respuesta plantar flexora bilateral. El resto del examen es normal.
Cuál es el diagnóstico más probable?
A) Oclusión de la arteria basilar.
B) Hemorragia del lóbulo frontal.
C) Hemorragia subaracnoidea.
D) Oclusión de la arteria carótida.
E) Infarto cardioembólico del cerebro.
Respuesta correcta: C
Objetivo educacional: diagnosticar una hemorragia subaracnoidea aguda.
Los diferentes subtipos clínicos de accidente cerebrovasculares: hemorragia intracerebral, hemorragia subaracnoidea e infarto pueden diferenciarse sobre la base de su presentación clínica. Los estudios de laboratorio, como los procedimientos de imágenes confirman el diagnóstico inicial sugerido por los síntomas y signos. La característica clave en la presentación de los pacientes incluye: cefaleas muy intensas, súbitas, con pérdida de la conciencia y una notable ausencia de signos y síntomas neurológicos focales. La pérdida de la conciencia requiere una disfunción bihemisférica difusa, que, junto con la rigidez de nuca, es una presentación típica de la hemorragia subaracnoidea. Los signos de foco pueden observarse en la hemorragia subaracnoidea, pero menos a menudo que en otros subtipos de accidente crebrovascular. La causa más común de hemorragia subaracnoidea espontánea es el aneurisma. Las malformaciones vasculares son 10 veces menos comunes.
La oclusión de la arteria basilar también puede presentarse con una súbita cefalea y pérdida de la conciencia. Esta arteria nutre al sitema activador reticular por lo que los pacientes con oclusión de la basilar tienen riesgo de coma. Sin embargo, se encuentran comúnmente signos, y síntomas focales. Estos pueden incluir hemiparesia, debilidad facial y bulbar, y movimientos oculares anormales.
Es poco probable que la hemorragia intracerebral, a menos que sea masiva y afecte el hemisferio opuesto pueda producir coma. En el accidente cerebrovascular las lesiones que afectan solo un hemisferio habitualmente no producen coma. Debido a que muchas hemorragias intracerebrales no alcanzan las meninges, la cefalea a menudo está ausente. La presentación clásica es el comienzo abrupto de signos de foco, a menudo asociado con náuseas y vómitos. Se puede observar una progresión gradual en horas.
Los pacientes con una oclusión de la arteria carótida se presentan con una disfunción en el territorio de una de las arterias carótidas, lo que puede producir por ejemplo afasia, hemiparesia y hemianopsia. Pueden ocurrir cefaleas, pero una cefalea importante, súbita y estado de coma no se ven en el accidente cerebrovascular isquémico secundario a la enfermedad de la arteria carótida.
El embolismo cardíaco puede comprometer cualquier arteria cerbral, y el déficit focal habitualmente va a ser máximo al comienzo, con o sin cefaleas. Una cefalea grave, súbita, y estado de coma no son típicos de este subtipo de accidente cerebrovascular, excepto en la rara circunstancia de que ambos hemisferios estén involucrados de manera simultánea por el embolismo.
Bibliografía:
1) Adams HP Jr, Jergenson DD, KasselNF. Sahs AL. Pitfalls in the recognition of subarachnoid hemorrhage. JAMA 244:794-6
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians
domingo, 7 de junio de 2009
Paciente de 37 años con vértigo, parálisis facial, y convulsiones generalizadas.
Dr. Sang-Woo Han (Neurología): Una mujer de 37 años fue vista en el departamento de emergencias de este hospital debido a convulsiones. Cuatro meses antes, comenzó a presentar episodios de vértigos que ocurrian varias veces a la semana y que duraban varias horas, acompañados de náuseas y vómitos. Ella fue evaluada en el departamento de emergencias de otro hospital, donde se le prescribió meclizina, y se le recomendó ver a su clínico de cabecera. Durante los siguientes 3 meses, ella tuvo episodios de vértigo varias veces por semana que se asociaba a tinitus, disminución de la audición, una sensación de plenitud en el oido derecho, y dificultad para caminar.
Los resultados de los exámenes otoscópicos y audiométricos realizados por un otorrinolaringólogo fueron normales, sin alteración en los pares craneales; se hizo diagnóstico de hidropesía endolinfática y se recomendó una dieta hiposódica.
Cinco semanas antes de la admisión actual, una TAC de senos paranasales reveló un leve engrosamiento mucoso de los senos maxilares con leves cambios inflamatorios en los senos etmoidales. Se comenzó con hidroclorotiazida y triamtereno y se continuó con meclizina, con alivio parcial de los síntomas.
Un electrocardiograma mostró taquicardia sinusal. Se le administró lorazepan y fenitoína por vía endovenosa. Una TAC de cráneo sin contraste endovenoso no demostró hemorragia cerebral.
Después de la TAC de cráneo, la paciente tuvo severo dolor en la cadera izquierda, por lo que se le administró sulfato de morfina y nuevamente lorazepan. Fue transferida a nuestro hospital 7 horas después de su arribo al departamento de emergencias referido.
La madre dijo que la paciente había tenido recientemente cefalea, dolor de oído, dolor en cadera izquierda, y que su apetito había disminuido. Tenía antecedentes de convulsiones febriles durante la niñez. Seis años antes, había tenido una fractura traumática de la cadera izquierda; 3 años después de esa fractura se llevó a cabo un reemplazo total de esa cadera debido a osteonecrosis. Había sido sometida a amigdalectomía, conización del cuello uterino y operaciones cesáreas. Presentaba amenorrea desde hacía 18 meses. Un test de HIV había sido negativo. Era nativa de Alaska y había sido adoptada en su infancia. Sus hijos eran sanos; no había información de otros familiares. Era soltera, vivía con sus tres hijos y no usaba drogas ilícitas. Tenía probablemente alergias a codeina y penicilina. Los medicamentos que tomaba eran meclizina, triamtereno e hidroclorotiazida.
En el examen, la paciente estaba inicialmenet somnolienta, pero se despertaba con los estímulos; después se puso beligerante, combativa, y no cooperaba.
La temperatura era de 36,6ºC, la presión arterial era de 95/64 mmHg, el pulso de 100 por minuto, la frecuencia respiratoria de 16 por minuto, y la saturación de oxígeno de 97% mientras el paciente respiraba aire ambiente. Su afectividad iba desde el enfado hasta el llanto. Estaba orientada en si misma pero no en tiempo y espacio. Las piezas dentarias estaban en mal estado de conservación; el abdomen era blando y levemente doloroso a la palpación profunda. El resto del examen era normal. Había asimetría en los músculos de la cara, con debilidad del lado derecho. Las pupilas eran reactivas; los movimientos extraoculares estan intactos, con nistagmus horizontal y movimientos sacádicos en el seguimiento, sin ptosis. La audición estaba intacta; la protrusión de la lengua estaba centrada en la linea media, y había leve disartria. Otros pares craneales, la atención, memoria, y la capacidad de hacer cálculos no fueron medidos. Había limitación al movimiento en la pierna izquierda debido a dolor en la cadera; la fuerza motriz era por otro lado normal. Los brazos y piernas estaban hiperreflécticos; la respuesta plantar era extensora bilateralmente. La postura, marcha y braceo estaban marcadamente alterados. Caminaba con los pies hacia dentro y sobre sus dedos, con marcha a pequeños pasos.
El hemograma, nivel de elctrolitos, glucemia, bilirrubina, y proteínas eran normales; los tests de función hepática y renal eran normales. Un test de embarazo fue negativo en sangre y en orina. El análisis de orina fue normal, excepto en el screening toxicológico que era positivo para opiáceos.
Las Rx de tórax, caderas pelvis, y pies fueron normales. La RMN de cerebro, llevada a cabo después de la administración de lorazepan, era limitada en cuanto a su interpretaciónpor artefactos de movimiento de la paciente, pero revelaba zonas hiperintensas en lóbulos temporales mediales en T2 y en fluid-attenuated inversion recovery (FLAIR) bilateralmente y en el giro recto posterior, más prominentes del lado izquierdo que en el derecho. Había una casi opacificación completa del seno maxilar derecho.
Fue admitida al servicio de neurología
Durante los primeros 3 días, la paciente permaneció agitada, beligerante y confusa, requiriendo el uso de inmovilización a la cama.
Se le administró fenitoína, magnesio, aciclovir, ácido fólico, tiamina, parches transdérmicos de nicotina, y dalteparina. También se la medicó con lorazepan y olanzapina para el cuadro de agiatación, e hidromorfona y morfina según dolor. El tercer día de hospitalización fue evaluada por un psiquiatra. Ella estaba somnolienta, confusa, desorientada en tiempo y espacio, con trastornos de la memoria. Era distraída fácilmente, y tenía una palabra arrastrada y un pensamiento tangencial. La PCR era de 23,2 mg/L (normal menos de 8); la eritrosedimentación, nivel de electrolitos, y electroencefalograma eran normales. Se suspendió olanzapina y se admiistró haloperidol.
El cuarto día de hospitalización, su estado mental mejoró y no hubo más necesidad de sujetarla a la cama. Su humor era agradable y colaboraba con el personal de la sala. Tenía un pensamiento lineal, podía nombrar 3 objetos 5 minutos después de habérselos mostrado. Conocía el nombre de los últimos presidentes. Los movimientos extraoculares eran normales y no había nistagmus. Había parálisis facial derecha y aumento del tono extensor de ambas piernas, los tobillos estaban extendidos hacia las plantas. La fuerza motora era normal. El examen de la sensibilidad era normal. Había hiperreflexia en miembros superiores e inferiores y clonus sotenido en tobillo izquierdo, los reflejos plantares eran en extensión. La marcha era anormal debido
 a hipertonía.
a hipertonía.Se llevó a cabo una punción lumbar (Tabla 1).
El examen citológico del líquido reveló aumento de los linfocitos, de apariencia madura. Un test de PPD fue negativo. La citometría de flujo mostró células T con una relación CD4:CD8 de 3:4. La RMN reveló áreas multifocales extensas, con realce nodular, que afectaban leptomeninges y epéndimo, junto a los vasos lentículoestriados, hipocampo, y nervios ópticos bilateralmente, dentro del giro recto izquierdo, quiasma óptico y tallo pituitario, y dentro del canal auditivo interno derecho. Existian zonas de hiperintensidades de los lóbulos temporales mesiales, giro recto izquierdo fueron notados en T2 y FLAIR. La angioRMN de cabeza y cuello fue normal.
El 7º día de hospital, una RMN de columna mostró realce nodular en leptomeninges que afectaban la médula cervical y cono medular, así como compromiso parenquimatoso de la médula espinal cervical. La TAC de tórax, abdomen y pelvis mostró linfadenopatía hiliar bilateral y linfadenopatía mediastinal, leve engrosamiento de las paredes bronquiales y pequeños ganglios linfáticos mesentéricos y retroperitoneales. Los FAN fueron positivos a 1:320 con patrón moteado. Los niveles séricos de TSH, prolactina, FSH, y VDRL fueron todos negativos.
Se suspendieron dalteparina y aciclovir.
Una biopsia transbronquial de pulmón en el día 12º reveló fibrosis intersticial inespecífica sin evidencias de granulomas ni cáncer. La paciente fue dada de alta el mismo día a su requerimiento siendo concertada su reinternación para tres días más tarde. Fueron llevadas a cabo biopsias de la dura y del cerebro en su reinternación; el examen anatomopatológico de las biopsias revelaron corteza y meninges normales. El nivel de angiotensina sérica (ACE) fue de 36 U/l (normal 7 a 46)
Un procedimiento diagnóstico fue llevado a cabo
Diagnóstico diferencial:
Dr. Didier Cros: Esta paciente de 37 años, previamente sana tuvo una historia de 4 meses de manifestaciones neurológicas, que incluían vértigo, náuseas, parálisis facial, síndrome piramidal bilateral, y convulsiones, que eran sugestivas de patología multifocal del sistema nervioso central, una amenorrea de larga data que puede indicar disfunción endócrina, Ella estaba afebril y era HIV negativa. Puedo ver el resultado de los estudios radiológicos?
Dr. R. Gilberto Gonzalez: Los intentos de hacer una RMN al ingreso fueron alterados por los movimientos de la paciente, a pesar de
 la sedación. Se repitió entonces la RMN el día 4 (Figura 1A y 1B) que mostraron extensas anormalidades de la señal, y realce anormal que afectaba la leptomeninge, las células ependimarias que tapizan las cavidades, y el parénquima, con un patrón tanto linear como nodular. Había engrosamiento y un realce difuso tanto linear como nodular del tallo pituitario. La RMN de la columna hecha el día 7 (Figura 1C) revelaron compromiso difuso de la espina con realce tanto de la leptomeninge con un patrón linear y nodular como del parénquima de la médula espinal; más prominente en las áreas cervicales superiores. La TAC de tórax llevada a cabo el mismo día reveló linfadenopatías pretraqueales e hiliares bilaterales (Figura 1D)
la sedación. Se repitió entonces la RMN el día 4 (Figura 1A y 1B) que mostraron extensas anormalidades de la señal, y realce anormal que afectaba la leptomeninge, las células ependimarias que tapizan las cavidades, y el parénquima, con un patrón tanto linear como nodular. Había engrosamiento y un realce difuso tanto linear como nodular del tallo pituitario. La RMN de la columna hecha el día 7 (Figura 1C) revelaron compromiso difuso de la espina con realce tanto de la leptomeninge con un patrón linear y nodular como del parénquima de la médula espinal; más prominente en las áreas cervicales superiores. La TAC de tórax llevada a cabo el mismo día reveló linfadenopatías pretraqueales e hiliares bilaterales (Figura 1D)Dr. Cros: Un gran número de trastornos pueden afectar las leptomeninges y el parénquima del cerebro y la médula espinal, y pueden envainar las raíces de los nervios craneales y de los nervios espinales. La presencia de adenopatías mediastínicas e hiliares en este paciente ayudan a enfocar el diagnóstico diferencial. Yo participé en el tratamiento de esta paciente y nuestras consideraciones diagnósticas incluyeron causas neoplásicas, infecciosas, e inflamatorias y granulomatosas.
Trastornos neoplásicos
La metástasis de cáncer sistémico fueron siempre una preocupación desde la internación de esta paciente, aún aunque no existía enfermedad maligna demostrada de base. Los tumores que metastizan a las meninges son los de mama, pulmón, cánceres gastrointestinales, melanoma, y linfomas principalmente. En ausencia de cáncer conocido, y con los resultados normales del examen clínico de piel, mamas, pero con con una TAC toracoabdominopelviana, que muestra adenopatías mediastínicas, mesentéricas y retroperitoneales, la sospecha de linfoma sistémico es alta. Los linfomas primarios del sistema nervioso central fueron también considerados, ya que el compromiso leptomeningeo ocurre en 40% de los casos con linfoma primario de sistema nervioso central, y es es la forma de presentación en 8% de los casos. (1,2)
El examen del líquido cefalorraquídeo es central en el diagnóstico de carcinomatosis meningea. El líquido cefalorraquíeo fue obtenido por punción lumbar, que es la forma óptima para diagnosticar posible infiltración maligna, ya que la cauda equina es a menudo afectada por el proceso patológico. Los resultados falsos negativos pueden ocurrir si el líquido cefalorraquídeo es obtenido de un compartimiento no afectado del espacio subaracnoideo. El examen citológico en el caso de esta paciente, no reveló células malignas, y la citometría de flujo no mostró evidencias de linfoma.
Enfermedades infecciosas:
Un número de enfermedades infecciosas pueden afectar las leptomeninges. La tuberculosis tiene predilección por las leptomeninges de la base de cráneo y frecuentemente afecta pares craneales, causando una vasculitis de las arterias penetrantes que pueden resultar en strokes y también causar obstrucción al flujo del líquido cefalorraquídeo, causando hidrocefalia. Aunque rara (menos de 200 casos por año en EE UU), la tuberculosis del sistema nervioso central debe ser diagnósticada y tratada rápidamente, ya que el pronóstico es pobre a pesar de la terapia apropiada. El examen del líquido cefalorraquídeo no reveló bacilos ácido-alcohol resistentes, pero este examen debe ser repetido si la sospecha clínica es alta. En esta paciente la sospecha diagnóstica de tuberculosis no era fuerte por la cronicidad de los síntomas, la ausencia de fiebre, la eritrosedimentación normal, la ausencia de lesiones cavitarias pulmonares y la PPD negativa.
La sífilis también fue considerada, ya que la neurosífilis temprana puede dar un patrón similar a los que fueron documentados en las imágenes y el examen del líquido de esta paciente. La inflamación leptomeningea florida causa múltiples neuropatías craneales, vasculitis infecciosa con posible stroke e hidrocéfalo. El compromiso parenquimatoso en el cerebro y la médula espinal, pueden ser consecuencia de un goma sifilítico. Este diagnóstico fue descartado por la VDRL negativa en sangre y líquido cefalorraquídeo.
La neuroborreliosis puede causar un patrón similar a la sífilis, incluyendo meningitis, y encefalomielitis, que pueden ser más comunes con las cepas de borrelias de Europa que con las vistas en EE UU. (3) De hecho, la similitud anatomopatológica entre la sífilis meningovascular y la neuroborreliosis ha sido descripto. (4) La infección primaria con borrelia es mucho más común que la sífilis en Nueva Inglaterra. Las manifestaciones neurológicas desarrollan en 15% de los pacientes con enfermedad de Lyme, e incluyen neuropatías craneales, radiculopatias dolorosas, y meningitis linfocitaria. La neuropatía generalizada de la enfermedad de Lyme es indistinguible del síndrome de Guillain-Barré. En esta paciente, los tests de anticuerpos y la PCR para DNA de borrelia fueron negativos, descartando enfermedad de Lyme.
Enfermedades inflamatorias y granulomatosas.
En la granulomatosis de Wegener, la meningitis puede ocasionalmente ser la presentación inicial, (5) aunque las neuropatías periféricas y craneales son la manifestación neurológica más común. La granulomatosis de Wegener generalmente afecta la vía aérea superior e inferior, así como el riñón. La eritrosedimentación normal, y la ausencia de lesiones pulmonares en esta paciente, argumentan contra este diagnóstico, como también lo hicieron los sensibles y específicos ANCA que fueron negativos.
La posibilidad de lupus eritematoso sistémico (LES) fue discutido, ya que los FAN fueron positivos a 1:320. El compromiso leptomeningeo y la mielopatía pueden ser vistas en pacientes con LES aunque son raras. (6) Otras manifestaciones neuropsiquiátricas en el LES incluyen: stroke, ataques isquémicos transitorios, convulsiones, psicosis, trastornos cognitivos y demencia, y delirium. (7) Esta paciente tenía muchas de estas manidfestaciones en el momento de su admisión. La presentación neurológica primaria del LES ocurre en 24% de los casos, (6) usualmente en pacientes con FAN positivos y anti DNA nativo positivo.
Otros trastornos inflamatorios también fueron considerados. La artritis reumatoidea puede causar enfermedad de sistema nervioso central, pero esto ocurre en pacientes con severa artritis reumatoidea y factor reumatoideo positivo. (8) El síndrome de Sjögren en raras ocasiones causa meningoencefalitis, pero los anticuerpos que habitualmente se asocian a síndrome de Sjögren estaban ausentes.
Neurosarcoidosis
El diagnóstico de neurosarcoidosis fue considerado como el más probable, en vista del los patrones de compromiso de sistema nervioso central por la RMN, y las linfadenopatías mediastinales e hiliares.
La neurosarcoidosis es una enfermedad granulomatosa crónica que varía en incidencia a lo largo del mundo y entre los distintos grupos étnicos. En EE UU la incidencia anual entre negros es tres veces mayor que entre blancos. (9) No estoy seguro de la incidencia entre los esquimales. La enfermedad afecta pacientes de todas las edades pero más comunmente se ve en adultos jóvenes, tal como esta paciente. La sarcoidosis afecta más comunmente los pulmones, ojos, y piel. De acuerdo a los estudios de autopsias, el sistema nervioso se afecta en hasta el 25% de los pacientes, (10) pero solo alrededor de la mitad de estos pacientes tienen tienen manifestaciones neurológicas. (2) Alrededor del 40% de los pacientes con neurosarcoidosis tienen diagnosticada previamente sarcoidosis en otro órgano, más comunmente el tórax o la úvea anterior, a diferencia de nuesta paciente. (11,12) Las neuropatías craneales, particularmente ópticas y faciales, son las manifestaciones más frecuentes de la neurosarcoidosis y son vistas en el 30% al 40% de los pacientes con neurosarcoidosis. El compromiso de la médula espinal y de las meninges, vistas en esta paciente, son también comunes. (12) Raramente, la psicosis puede ocurrir, como se vió en esta paciente.
Los hallazgos en la RMN de cerebro, típicamente incluyen múltiples lesiones en sustancia blanca, con o sin realce meningeo, pero una única lesión parenquimatosa, una lesión del nervio óptico, o lesiones de la médula espinal pueden verse también, y también la RMN puede ser completamente normal. (11) El compromiso del hipotálamo, la pituitaria, o ambos, ocasionalmente ocurre en pacientes con neurosarcoidosis, como pasó en esta paciente, y pueden ser responsables de la amenorrea que tenía la paciente. (1,12)La enzima convertidora (ACE) es producida por el granuloma sarcoide, y su nivel, está elevado en 60% de los pacientes con sarcoidosis. Un nivel sérico normal de ACE , como se vió en esta paciente, no elimina la posibilidad de sarcoidosis. La sensibilidad y especificidad de los niveles de ACE en el líquido cefaloraquídeo son desconocidas.
El diagnóstico de neurosarcoidosis debe ser confirmado por examen microscópico de una muestra de biopsia. Debido a que los granulomas no caseosos no son patognomónicos de sarcoidosis, el patrón de compromiso neurológico y orgánico debe ser consistente con sarcoidosis, y otros diagnósticos alternativos deben ser descartados. El diagnóstico de neurosarcoidosis es considerado definitivo si los granulomas son vistos en las muestras de biopsias de cerebro y meninges, y es considerado un diagnóstico probable, si las muesras son obtenidas de tejidos que no son sistema nervioso central, como pulmón o ganglios linfáticos. En esta paciente, después de que la biopsia de pulmón no mostró evidencias de granulomas ni cáncer, nosotros decidimos llevar a cabo una biopsia de cerebro y meninges, ya que esta paciente con esta constelación de hallazgos clínicos, la detección de granulomas no caseosos en el cerebro aseguraría el diagnóstico de sarcoidosis y descartaría otros diagnósticos. Los resultados de las biopsias de cerebro y meninges fueron normales; por lo tanto, el blanco natural de nuestro approach diagnóstico fueron los ganglios mediastinales.
Diagnóstico del Dr. Didier Cros's
Neurosarcoidosis.
Discusión anatomopatológica:
Dr. Eugene J. Mark: Se llevó a cabo una mediastinoscopía con biopsia de varios ganglios. En el examen histopatológico, compactos granulomas, no necrotizantes, ocupaban aproximadamente 80% del tejido linfático (Figura 2A). El ganglio linfático tenía áreas de esclerosis (Figura 2B) y el colágeno hi
 alino estaba rodeando granulomas individuales, Todos los granulomas eran histológicamente similares. Los granulomas de la sarcoidosis han sido descriptos como diferentes a los granulomas de las infecciones micobacterianas. (13,14) Las tinciones especiales y los cultivos de las biopsias de los ganglios linfáticos fueron negativos para microorganismos. La combinación de los hallazgos clínicos, histológicos, y radiográficos nos llevaron al diagnóstico de sarcoidosis. (13,14)
alino estaba rodeando granulomas individuales, Todos los granulomas eran histológicamente similares. Los granulomas de la sarcoidosis han sido descriptos como diferentes a los granulomas de las infecciones micobacterianas. (13,14) Las tinciones especiales y los cultivos de las biopsias de los ganglios linfáticos fueron negativos para microorganismos. La combinación de los hallazgos clínicos, histológicos, y radiográficos nos llevaron al diagnóstico de sarcoidosis. (13,14)La distribución de los granulomas en la sarcoidosis difiere algo en los distintos órganos. En el pulmón, los granulomas están preferentemente distribuidos en las vías de los linfáticos. (15,16,17). En el sistema nervioso central, los granulomas de la sarcoidosis afectan preferentemente las meninges, como sucedió en el caso de esta paciente. También afectan la zona ependimaria con extensión a los plexos coroideos, y forman nódulos y masas tumorales que se extienden al parénquima. (18,19)
Dr. Nancy Lee Harris (Patología): Dr. Sheth, podría decirnos como fue la evolución de esta paciente?
Dr. Kevin N. Sheth (Neurología): Cuando la paciente llegó, estaba francamente psicótica, y llevó varios días de tratamiento hasta poder obtener una historia y un examen físico completos. No nos había quedado claro si su estado mental era debido a neurosarcoidosis, a fenómenos post-ictales o reacción al lorazepan. Después de realizar el diagnóstico de neurosarcoidosis nosotros comenzamos tratamiento con altas dosis de prednisona. La paciente tuvo una respuesta dramática, con resolución de su vértigo y resolución gradual de sus síntomas neurológicos; la fenitoína fue discontinuada. Varios meses después de comenzado el tratamiento con prednisona, sus ciclos menstruales se restablecieron. Ocho meses después del alta hospitalaria, todavía presenatba hiperreflexia residual, pero su fuerza y la marcha eran normales; la prednisona fue discontinuada.
Diagnóstico anatómico:
Neurosarcoidosis.
Traducción de:
Case 6-2009 — A 37-Year-Old Woman with Vertigo, Facial Weakness, and a Generalized Seizure
Didier Cros, M.D., R. Gilberto Gonzalez, M.D., Ph.D., and Eugene J. Mark, M.D.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Volume 360: 802-809. February 19,2009. Number 8
Source Information
From the Department of Neurology (D.C.); the Division of Neuroradiology, Department of Radiology (R.G.G.); and the Department of Pathology (E.J.M.), Massachusetts General Hospital; and the Departments of Neurology (D.C.), Radiology (R.G.G.), and Pathology (E.J.M.), Harvard Medical School.
References
1) Murialdo G, Tamagno G. Endocrine aspects of neurosarcoidosis. J Endocrinol Invest 2002;25:650-662. [ISI][Medline]
2) Scott TF, Yandora K, Valeri A, Chieffe C, Schramke C. Aggressive therapy for neurosarcoidosis: long-term follow-up of 48 treated patients. Arch Neurol 2007;64:691-696. [Free Full Text]
3) Steere AC. Lyme disease. N Engl J Med 2001;345:115-125. [Free Full Text]
4) Miklossy J, Kuntzer T, Bogousslavsky J, Regli F, Janzer RC. Meningovascular form of neuroborreliosis: similarities between neuropathological findings in a case of Lyme disease and those occurring in tertiary neurosyphilis. Acta Neuropathol (Berl) 1990;80:568-572. [CrossRef][Medline]
5) Al Dhanhani A, Macaulay R, Maloney B, Hanly JG. Meningeal involvement in Wegener's granulomatosis. J Rheumatol 2006;33:364-367. [Free Full Text]
6) Joseph FG, Lammie GA, Scolding NJ. CNS lupus: a study of 41 patients. Neurology 2007;69:644-654. [Free Full Text]
7) Jennekens FG, Kater L. The central nervous system in systemic lupus erythematosus. 1. Clinical syndromes: a literature investigation. Rheumatology (Oxford) 2002;41:605-618. [CrossRef][Medline]
8) Starosta MA, Brandwein SR. Clinical manifestations and treatment of rheumatoid pachymeningitis. Neurology 2007;68:1079-1080. [Free Full Text]
9) Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med 2007;357:2153-2165. [Free Full Text]
10) Iwai K, Tachibana T, Takemura T, Matsui Y, Kitaichi M, Kawabata Y. Pathological studies on sarcoidosis autopsy. I. Epidemiological features of 320 cases in Japan. Acta Pathol Jpn 1993;43:372-376. [Medline]
11) Zajicek JP, Scolding NJ, Foster O, et al. Central nervous system sarcoidosis -- diagnosis and management. QJM 1999;92:103-117. [Free Full Text]
12) Lower EE, Broderick JP, Brott TG, Baughman RP. Diagnosis and management of neurological sarcoidosis. Arch Intern Med 1997;157:1864-1868. [Free Full Text]
13) Hsu RM, Connors AF Jr, Tomashefski JF Jr. Histologic, microbiologic, and clinical correlates of the diagnosis of sarcoidosis by transbronchial biopsy. Arch Pathol Lab Med 1996;120:364-368. [ISI][Medline]
14) Rosen Y, Vuletin JC, Pertschuk LP, Silverstein E. Sarcoidosis: from the pathologist's vantage point. Pathol Annu 1979;14:405-439. [Medline]
15) Judd PA, Finnegan P, Curran RC. Pulmonary sarcoidosis: a clinico-pathological study. J Pathol 1975;115:191-198. [CrossRef][ISI][Medline]
16) Mitchell DN, Scadding JG, Heard BE, Hinson KF. Sarcoidosis: histopathological definition and clinical diagnosis. J Clin Pathol 1977;30:395-408. [Free Full Text]
17) Perry A, Vuitch F. Causes of death in patients with sarcoidosis: a morphologic study of 38 autopsies with clinicopathologic correlations. Arch Pathol Lab Med 1995;119:167-172. [ISI][Medline]
18) Lara Capellan JI, Cuellar Olmedo L, Martinez Martin J, et al. Intrasellar mass with hypopituitarism as a manifestation of sarcoidosis: case report. J Neurosurg 1990;73:283-286. [ISI][Medline]
19) Stern BJ, Krumholz A, Johns C, Scott P, Nissim J. Sarcoidosis and its neurological manifestations. Arch Neurol 1985;42:909-917. [Free Full Text]
viernes, 5 de junio de 2009
Mejor respuesta.
Exámenes de laboratorio:
Hematocrito 31%
Urea 44 mg/dl
Calcio sérico 10,9 mg/dl
Fosfato sérico 4,2 mg/dl
Creatinina plasmática 2,1 mg/dl
Albúmina plasmática 3,2 g/dl
La Rx de columna muestra múltiples fracturas por compresión (aplastamientos) en T-10, T-11, L-3, L-4 y L-5. Se observa osteopenia difusa.
El siguiente estudio más importante para esta paciente es:
A) Hormona paratiroidea intacta en plasma.
B) 1,25-dihidroxivitamina D en plasma.
C) Electroforesis de proteínas plasmáticas.
D) Calcitonina.
E) Estudio de densidad mineral ósea, mediante absorciometría de rayos x de energía dual.
Respuesta correcta : C
Objetivo educacional: Reconocer las complicaciones esqueléticas del mieloma múltiple.
Aunque la osteoporosis es una enfermedad extremadamente común en mujeres ancianas, el clínico debe mantener un alto grado de vigilancia para la presentación atípica de otras condiciones benignas y malignas que puedan producir osteopenia. La pérdida avanzada de hueso, asociado con hipercalcemia, anemia y uremia, sugiere un proceso maligno subyacente en esta mujer de 73 años de edad. El mieloma múltiple puede ser un diagnóstico unificante, y es indispensable hacer una electroforesis de las
proteínas plasmáticas, las que probablemente puedan confirmar el diagnóstico. En el mieloma múltiple se liberan citoquinas osteoactivas de las células plasmáticas anormales, causando osteólisis local, destrucción de la arquitectura del hueso y liberación no regulada de calcio. La insuficiencia renal de esta paciente probablemente es secundaria a depósito tubular de proteínas plasmáticas y nefrocalcinosis.
El hiperparatiroidismo primario puede llevar a este grado de osteoporosis al igual que la hipercalcemia. La hipercalcemia prolongada también puede producir una pérdida progresiva de la función renal. No obstante, a menos que exista una severa fibrosis medular, tal como ocurre en la etapa final de la enfermedad, la anemia es una característica poco común en el hiperparatiroidismo. Por lo tanto la determinación de los niveles séricos de parathormona (PTH) no sería muy útil en este momento. Es esperable que la parathormona esté suprimida en forma secundaria a esta variedad de hipercalcemia no mediada por PTH.
La medición de los metabolitos de la vitamina D tampoco brindaría información útil. Probablemente sean normales y la 1,25-dihidroxivitamina D puede encontrarse en el rango inferior de lo normal debido a la supresión de la PTH .
El nivel de calcitonina, un marcador de formación de hueso, a veces es útil para evaluar el grado de recambio óseo. Sin embargo, no agrega información para el diagnóstico diferencial y no es el test de elección en este momento.
Un estudio de la densidad mineral ósea mediante absorciometría con rayos X de energía dual podría ser útil para evaluar el grado de osteopenia, pero no ayudaría a descubrir la enfermedad subyacente.
Bibliografía:
Roodman GD. Osteoclast function in Paget´s disease and multiple myeloma. Bone; 17 (suppl 2) 575-615.
Ziegler R. What is a vertebral fracture? Bone. 18 (suppl 3) 1695-1778)
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians
martes, 2 de junio de 2009
Fiebre y lesiones ctutáneas en un niño de 10 años. Artritis séptica poliarticular (no gonocóccica)
 illo derecho, que fueron tratados con inmovilización. Su mano derecha y codo no habían sufrido traumatismo, y él había recibido acetaminofen como analgesia. Él tenía antecedentes de dermatomiositis para lo que estaba tomando ácido fólico y metotrexate. El niño impresionaba como enfermo, y tenía 38,4ºC de temperatura.
illo derecho, que fueron tratados con inmovilización. Su mano derecha y codo no habían sufrido traumatismo, y él había recibido acetaminofen como analgesia. Él tenía antecedentes de dermatomiositis para lo que estaba tomando ácido fólico y metotrexate. El niño impresionaba como enfermo, y tenía 38,4ºC de temperatura.Al retirar el yeso del tobillo, encontramos un severo enrojecimiento de la piel, calor e inflamación que se extendía desde la punta de los dedos hasta la tuberosidad anterior de la tibia. (Figura 1) Había una gran b
 ulla. Había una notable sensibilidad dolorosa a la palpación suave, e intenso dolor a la movilización pasiva, y el pulso pedio estaba disminuido. Su codo derecho (Figura 2) y la articulación metacarpofalángica del 5º dedo de mano derecha (Figura 3) estaban eritematosos, calientes e inflamados; sin embargo los pulsos eran normales. Los resultados de los exámenes de laboratorio mostraban leucocitosis 31.000/mm3 con 30.000 neutrófilos y 40% en cayado, con una eritrosedimentación de 103 mm/h.
ulla. Había una notable sensibilidad dolorosa a la palpación suave, e intenso dolor a la movilización pasiva, y el pulso pedio estaba disminuido. Su codo derecho (Figura 2) y la articulación metacarpofalángica del 5º dedo de mano derecha (Figura 3) estaban eritematosos, calientes e inflamados; sin embargo los pulsos eran normales. Los resultados de los exámenes de laboratorio mostraban leucocitosis 31.000/mm3 con 30.000 neutrófilos y 40% en cayado, con una eritrosedimentación de 103 mm/h.
B) Fiebre reumática aguda.
C) Infección gonocóccica diseminada.
D) Artritis séptica poliarticular (no gonocóccica).
E) Artritis reactiva
B) Llevar a cabo tests serológicos virales.
C) Consulta urgente por posible manejo quirúrgico.
D) A y C.
E) Iniciar medicación antiinflamatoria en ámbito hospitalario
Discusión
La primer respuesta es (D) artritis séptica poliarticular (nogonocóccica) , y el siguiente paso es (D), obtener hemocultivos, comenzar tratamiento con amplio espectro de antibióticos, y realizar una consulta quirúrgica de inmediato.
Nuestra preocupación acerca de fascitis necrotizante que requiera cirugía nos hizo llevar el paciente a cirugía inmediata simultaneamente al comienzo con antibioticoterapia de amplio espectro. La exploración en la sala de operaciones reveló necrosis no fascial en pierna derecha. El resultado de la tinción de Gram del aspirado articular mostró cocos Gram (+) (10 cocos por campo de alto poder), y los cultivos tomados de su tobillo, codo, y metacarpofalángica desarrolló Streptococcus pyogenes. Los hemocultivos fueron negativos.
Después de varios días de ATB intravenosos, su fiebre desapareció y fue dado de alta. Él recibió 6 semanas adicionales de ATB intravenosos y orales debido a que no se pudo descartar osteomielitis en base a las imágenes, y no se le realizó centelleograma óseo.
En nuestro caso, el paciente estaba inmunosuprimido debido a terapia con metotrexato.
Los posibles orígenes de su bacteriemia incluyen extensión directa desde una celulitis o artritis de tobillo, o, menos probablemente desde la faringe.
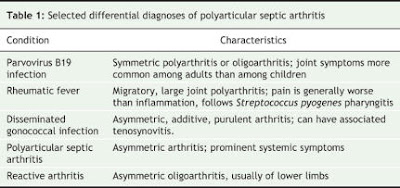 lar ( 4 o menos articulaciones afectadas), a menudo las rodillas (Tabla 1) (clickear sobre la Tabla para ampliarla) En adultos, el parvovirus B19 puede presentarse como poliartitis aguda (5 o más articulaciones afectadas), con las articulaciones interfalángicas proximales o metacarpofalángicas más a menudo afectadas, y con rash asociado en 75% de los casos.
lar ( 4 o menos articulaciones afectadas), a menudo las rodillas (Tabla 1) (clickear sobre la Tabla para ampliarla) En adultos, el parvovirus B19 puede presentarse como poliartitis aguda (5 o más articulaciones afectadas), con las articulaciones interfalángicas proximales o metacarpofalángicas más a menudo afectadas, y con rash asociado en 75% de los casos. Sergio T. Fenella, MD* and Fred Y. Aoki, MD
*Department of Medical Microbiology; Department of Clinical Pharmacology, University of Manitoba, Winnipeg, Man.
CMAJ. 2008 May 20; 178(11): 1427–1428.
doi: 10.1503/cmaj.071555
Bibliografía
1) Frank G, Mahoney HM, Eppes SC. Musculoskeletal infections in children. Pediatr Clin North Am 2005;52:1083-106.[CrossRef][Medline]
2) Diaz-Borjon A, Lian S. Multifocal septic arthritis: an unusual complication of invasive Streptococcus pyogenes infection. Am J Med 2005;118:924-5.[CrossRef][Medline]
3) Elwood RL, Pelszynski MM, Corman LI. Multifocal septic arthritis and osteomyelitis caused by group A Streptococcus in a patient receiving immunomodulating therapy with etanercept. Pediatr Infect Dis J 2003;22:286-8.[CrossRef][Medline]
4) Christodoulou C, Gordon P, Coakley G. Polyarticular septic arthritis. BMJ 2006;333:1107-8.[Free Full Text]
5) Dubost JJ, Fis I, Denis P, et al. Polyarticular septic arthritis. Medicine (Baltimore) 1993;72:296-310.
Mejor respuesta
Estudios de laboratorio:
Tiroxina plasmática total 10,1 ug/dl
Triiodotironina plasmática 151 ng/dl
TSH 1.03 Uu/ml
Captación de yodo radiactivo a las 24 hs 19%.
El centelleograma de tiroides muestra una captación relativamente normal en toda la glándula con un foco caliente que coincide con la localización del nódulo, lo que sugiere un nódulo tiroideo hiperfuncionante.
En este momento, el paso más apropiado consiste en:
A) Ablación con yodo radiactivo .
B) Tiroidectomía subtotal.
C) Terapia supresita con levotiroxina.
D) Ecografía de tiroides.
E) Ninguno de los que figuran arriba.
Respuesta correcta: E
Objetivo educacional: identificar el manejo más apropiado para un paciente con un nódulo tiroideo hiperfuncionante.
Este hombre de 41 años de edad debe ser considerado eutiroideo por las siguientes razones: tiene niveles plasmáticos normales de tiroxina, triiodotironina, y TSH, y aunque el nódulo tiroideo es hiperfuncionante, su actividad no es suficiente para causar hipertiroidismo. Por lo tanto, el manejo preferible consiste en abstenerse de una intervención terapéutica, pero seguir al paciente cada seis meses para detectar posible hipertiroidismo si el nódulo se agranda.
No hay indicación para la ablación con yodo radiactivo dado que el paciente no está tirotóxico. No hay indicación para la tiroidectomía por hipertiroidismo o por preocupación acerca de la malignidad del nódulo.
Los hallazgos citológicos son totalmente compatibles con el diagnóstico del escaneo que muestra un nódulo hiperfuncionante, y sugieren la presencia de un adenoma folicular. En forma similar, dado que un nódulo hiperfuncionante suele ser sólido en la ecografía, este procedimiento no brindaría información útil.
Los nódulos hiperfuncionantes suelen ser autónomos, es decir, no se encuentran bajo el control de retroalimentación de la TSH pituitaria, y por lo tanto no responden al intento de supresión administrando hormona tiroidea exógena. En consecuencia, es probable que la administración de levotiroxina se sume a la producción autónoma de hormona tiroidea en el nódulo hiperfuncionante. Por lo tanto el tratamiento con levotiroxina está contraindicado, dado que esta terapia podría llevar al paciente desde el eutiroidismo a la tirotoxicosis.
Bibliografía:
1) Mazzaferri E. Manegement of a solitary thyroid nodule. N Eng J Med328 553-2) Gharib H, Goellner JR. Fine needle aspiration biopsy of the thyroid: an appraisal. Ann Intern Med 118 282-9
MKSAP (Medical Knowledge Self- Assesment Program). American College of Physicians
sábado, 30 de mayo de 2009
Una mujer de 47 años con rash y adormecimiento en las piernas
Una mujer de 47 años fue vista en una clínica reumatológica debido a adormecimiento y dolor en piernas asociado a rash.
La paciente había estado bien hasta hacía 2 años, cuando comenzó con adormecimiento, primero en cara lateral de pierna, tobillo y pie izquierdos, y después en una distribución idéntica del lado derecho. Aproximadamente 3 meses más tarde, desarrolló dolor en la región media del pie izquierdo seguido de dolor en la misma distribución en el pie derecho. Durante los siguientes 9 meses, el dolor se extendió hasta afectar ambas piernas en forma difusa. Un año antes de la consulta, desarrolló una inflamación aguda distal de la pierna izquierda después de un viaje en avión.

Una ultrasonografía llevada a cabo en otro hospital no mostró evidencias de trombosis venosa profunda. La inflamación desapareció espontáneamente en un período de 2 semanas. Seis a ocho meses antes de la actual evaluación, una coloración moteada en ambos pies tobillos y miembros inferiores, algunos nódulos aislados dolorosos de hasta 1,5 cm de diámetro que se blanqueaban parcialmente a la vitropresión.
Los resultados de laboratorio se muestran en la Tabla 1.
Clickear sobre la imagen para ampliarla.
Aproximadamente 8 semanas antes de la presentación, la paciente vio a su clínico. Los estudios ordenados en ese momento mostraron nivel sérico de electrolitos, albúmina, globulinas, TSH, ferritina, folato, vitamina B12 y test de función hepática y renal fueron todos normales. Los resultados de otros tests de laboratorio se muestran en la Tabla 1. Al día siguiente, un dermatólogo llevó a cabo una biopsia de piel en la región de la sien izquierda.
El examen histopatológico de la mostró inflamación perivascular y perifolicular con telangiectasias, que se interpretaron como dermatitis rosácea-like. Una semana más tarde, el examen histopatológico de una biopsia de un nódulo cutáneo en la región del tobillo izquierdo reveló un infiltrado linfohistiocitario focal, alrededor de una arteria muscular en el subcutáneo, sin evidencias de vasculitis o eritema nodoso.
Tres semanas antes de la consulta, la paciente vio a un reumatólogo particular. La paciente reportó en ese momento una historia personal de ojos secos (por lo que usaba gotas oftálmicas de ciclosporina), y adormecimiento, hormigueos, y cambios de color en los dedos de las manos en condiciones de frío extremo, sin palidez digital. La presión sanguínea era de 126/80 mmHg, el peso 57,8 kg, y la altura de 163,2 cm. Había una leve crepitación en la flexión pasiva de las rodillas, sin derrame articular.
Había lesiones eritematosas dispersas en cara, región anterior del tórax que desaparecían a la vitropresión. Había áreas irregulares de eritema en los pies y en las piernas que desaparecían parcialmente con la vitropresión. Se obsevaban nódulos. El resto del examen era normal. Los resultados de la electroforesis sérica, urinaria, y la inmunofijación (que detecta inmunoglobulinas y anticuerpos monoclonales en sangre y orina) eran normales. Otros resultados de laboratorio se muestran en la Tabla 1. Una semana más tarde, volvió al reumatólogo debido a dolor e hinchazón del tobillo izquierdo de 3 a 4 días de evolución. Un leve aumento de temperatura. Había un leve aumento de temperatura local y dolor a la palpación alrededor del maléolo, con un área de eritema de 1 cm de aspecto redondeado. El rango de movimiento en ambos tobillos era normal, y no había evidencias de entesopatía en la inserción del tendón de Aquiles. La fascia plantar no dolía a la palpación. No había sensibilidad a la exploración con pinchazos en las zonas maleolares. La eritrosedimentación era normal.
Dos semanas más tarde, vio a un reumatólogo de este hospital. En ese examen la paciente no reveló xerostomía, dolor o inflamación de articulaciones, debilidad, alopecía, rash malar, úlceras orales o de la lengua, linfadenopatía, dificultad respiratoria, dolor torácico, fiebre, sudoración nocturna, o cambios en el peso.
Ella había tenido varicela en su niñez, hipertensión leve de 10 años de evolución, y una peritonitis apendicular 15 años antes. Trabajaba como asesora fiscal, tomaba alcohol socialmente, y no fumaba. Su madre había tenido síndrome de Sjögren, hepatitis autoinmune, y enfermedad pulmonar intersticial pulmonar de la que había fallecido. Su padre había tenido neuropatía cuando era anciano. Una hermana mayor había presentado un año antes un cuadro diagnosticado como “vasculitis”. Una pariente materna tenía antecedentes de síndrome de Sjögren, pero no conocía detalles. La medicación de la paciente incluía vitaminas, anticonceptivos, y gotas oftálmicas de ciclosporina. Ella era alérgica a las sulfas.

En el examen, los signos vitales eran normales. El examen de la piel (Figura 1) demostró coloración moteada desde la mitad de la pantorrilla hacia distal, sugestiva de livedo reticularis. Un nódulo doloroso de 3 cm de diámetro estaba presente justo debajo del maléolo externo izquierdo; dos lesiones más chicas, y menos dolorosas estaban presentes en la misma área. Había pequeñas áreas coloreadas de aspecto aporcelanado en ambas piernas que la paciente dijo correspondían a antiguos nódulos. Había una disminución de la sensibilidad superficial en la parte central de ambos pies. No había dilatación capilar en los lechos ungueales, fenómeno de Raynaud, o inflamación o deformidad articulares. El resto del examen era normal.
La TAC de tórax y abdomen no mostró adenopatías ni infiltrados pulmonares. El recuento de glóbulos blancos era de 3000/mm3, con un recuento diferencial normal, hematocrito, hemoglobina, y recuento de plaquetas normales; el examen del frotis de sangre periférica no reveló anormalidades en las células blancas, rojas ni plaquetas.
Se llevó a cabo un procedimiento diagnóstico.
Cuál es el diagnóstico?
 reticularis, una red de coloración violácea de piel, típicamente en piernas, causada por la prominencia de los lechos venosos en la piel, sea por un trastorno en el flujo arterial, por dilatación venosa, o por obstrucción al flujo venoso. La livedo reticularis tiene una amplia lista de diagnósticos diferenciales (Tabla 2), (1) que pueden ser enfocadas considerando la historia personal y familiar de la paciente, la presencia o ausencia de lesiones de piel, y tests de laboratorio. La historia debe enfocarse en los elementos que sugieren condiciones autoinmunes potenciales, o procesos trombóticos. La madre de esta paciente tuvo severas complicaciones de síndrome de Sjögren, y la inflamación asimétrica de la pierna que la paciente tuvo varios meses antes de la presentación, puede haber representado un evento trombótico, aunque eso no fue probado. El examen de la piel debe enfocarse a la búsqueda de púrpura, nódulos, úlceras, cicatrices, anormalidades del lecho ungueal, y alteraciones en la temperatura corporal. En esta paciente, lesiones nodulares de piel, atrophie blanche, y rash en la cara estaban presentes, además del patrón de livedo reticularis.; yo discutiré las implicancias de estos hallazgos luego. La investigación de laboratorio debe incluir un estudio de hipercoagulabilidad, y un testeo serológico para enfermedades del tejido conectivo, que son negativos en esta paciente.
reticularis, una red de coloración violácea de piel, típicamente en piernas, causada por la prominencia de los lechos venosos en la piel, sea por un trastorno en el flujo arterial, por dilatación venosa, o por obstrucción al flujo venoso. La livedo reticularis tiene una amplia lista de diagnósticos diferenciales (Tabla 2), (1) que pueden ser enfocadas considerando la historia personal y familiar de la paciente, la presencia o ausencia de lesiones de piel, y tests de laboratorio. La historia debe enfocarse en los elementos que sugieren condiciones autoinmunes potenciales, o procesos trombóticos. La madre de esta paciente tuvo severas complicaciones de síndrome de Sjögren, y la inflamación asimétrica de la pierna que la paciente tuvo varios meses antes de la presentación, puede haber representado un evento trombótico, aunque eso no fue probado. El examen de la piel debe enfocarse a la búsqueda de púrpura, nódulos, úlceras, cicatrices, anormalidades del lecho ungueal, y alteraciones en la temperatura corporal. En esta paciente, lesiones nodulares de piel, atrophie blanche, y rash en la cara estaban presentes, además del patrón de livedo reticularis.; yo discutiré las implicancias de estos hallazgos luego. La investigación de laboratorio debe incluir un estudio de hipercoagulabilidad, y un testeo serológico para enfermedades del tejido conectivo, que son negativos en esta paciente.Una biopsia de piel puede estrechar un poco la lista de diagnósticos diferenciales separando los procesos inflamatorios de los procesos trombóticos. Biopsias de piel tomadas de al menos tres áreas de piel, que incluyan las zonas de atrophie blanche, la zona decolorada de la grasa subcutánea, aporta al diagnóstico en 80% de los casos de livedo reticularis. (2) Sin embargo, la biopsia de un nódulo subcutáneo podría haber sido de mayor ayuda.
Los pacientes con LES y vasculitis de mediano calibre tienen mayor prevalencia de mononeuritis múltiple, vasculitis visceral, y lesiones cutáneas isquémicas, pero menos probablemente esas pacientes tienen rash malar o lesiones discoides.(6)
Noventa y nueve por ciento de los pacientes con LES tienen FAN positivos. (7) Existen sin embargo LES con FAN verdaderos negativos, que son más raros aún después de introducida la técnica usando sustrato con células Hep-2. (8) Los pacientes con FAN negativos, a menudo tienen anticuerpos anti Ro(SS-A) o síndrome antifosfolipídico secundario. Esta paciente puede tener un LES FAN negativo.
Síndrome de Sjögren
Síndrome antifosfolipídico
Vasculopatía livedoide
Resumen
Poliarteritis nodosa cutánea.
LES FAN negativo con vasculopatía livedoide; no se puede descartar síndrome antifosfolipídico secundario
 engrosamiento e hialinización de los pequeños vasos de la dermis (Figura 2A), con focos sugestivos de pequeños microtrombos e infiltrados linfocitarios perivasculares (Figura 2 A insertada). No hay vasculitis leucocitoclástica o necrosis fibrinoide de la pared de los vasos. Este hallazgo morfológico es el cuadro diagnóstico de la vasculopatía livedoide.
engrosamiento e hialinización de los pequeños vasos de la dermis (Figura 2A), con focos sugestivos de pequeños microtrombos e infiltrados linfocitarios perivasculares (Figura 2 A insertada). No hay vasculitis leucocitoclástica o necrosis fibrinoide de la pared de los vasos. Este hallazgo morfológico es el cuadro diagnóstico de la vasculopatía livedoide.La vasculopatía livedoide se caracteriza histológicamente por una fina y aplanada epidermis, hialinización segmentaria de pequeños vasos en la dermis superficial, inflamación endotelial y capilares dilatados con asas tortuosas. La extravasación de células rojas con o sin hemosiderina, microtrombos, e infiltrados linfocitarios perivasculares son típicos. La ausencia de necrosis fibrinoide e inflamación de la pared de los vasos diferencia esta condición de las vasculitis. (21,22) La patofisiología de esta condición no es totalmente comprendida, y las hipótesis incluyen formación de pequeños trombos de fibrina alrededor de los pequeños vasos debido a escape de fibrina en la insuficiencia venosa crónica, atrapamiento de células blancas y subsecuente daño endotelial secundario a la hipertensión venosa, y activación de la vía procoagulante por anticuerpos antifosfolídicos; diferentes combinaciones de esos mecanismos pueden operar en diferentes contextos clínicos. (3,23) El daño de pequeñas venas cutáneas probablemente el cuadro clínico de la livedo reticularis (Figura 3)

Una potencial explicación para los conflictivos resultados de los FAN podría ser que entre la primera muestra, tomada en un laboratorio comercial, y la tomada en el ingreso a nuestro hospital hubo un intervalo de 8 semanas. Sin embargo, en pacientes con LES, los autoanticuerpos están presentes muchos meses a años antes del desarrollo de síntomas de LES. (24) Así, parece improbable que los FAN hayan sido negativos 8 semanas antes. Más aún, posteriormente se enviaron muestras de este paciente al mismo laboratorio comercial, y nuevamente los FAN fueron informados como negativos.
La explicación más probable para estos resultados conflictivos de FAN en este caso, es el uso de diferentes tests de screening para FAN. El laboratorio de inmunología clínica de este hospital usa inmunofluorescencia indirecta y células de la línea celular de carcinoma epidermoide (HEp-2) para investigar FAN.
La experiencia con este paciente sugiere que el cambio en el método de testeo puede ocasionar un fallo en diagnosticar una enfermedad sistémica autoinmune. Recientes reportes sugieren que la sensibilidad con el método de perlas fluorescentes para el diagnóstico de LES puede ser tan bajo como 49 a 58%. (26,27) Este caso ilustra la importancia del conocimiento del clínico, de cómo el laboratorio lleva a cabo los tests de screening para FAN. Si LES u otra enfermedad autoinmune sistémica es sospechada, pero el test de screening para FAN por método de ELISA o perlas fluorescentes son negativos, el test debe repetirse usando inmunofluorescencia indirecta con sustrato de células HEp-2.
La combinación de hallazgos en las tres biopsias, el FAN positivo, el anticuerpo anti dsDNA, y los elevados niveles de IgG anticardiolipinas sostienen el diagnóstico de vasculopatía livedoide asociada a LES.
Discusión del manejo
Nosotros optamos para tratar a esta paciente aspirina en dosis bajas e hidroxicloroquina, y planeamos el uso de warfarina, si la paciente no respondía al tratamiento inicial. Cuatro meses después de la presentación en nuestro hospital, había cesado la aparición de nódulos nuevos, la apariencia livedoide de las piernas se había resuelto, y, tanto el dolor como el adormecimiento habían mejorado.
La paciente: En el momento en que consulté con el Dr Stone, estaba virtualmente postrada. Mi mejoramiento fue muy gradual, pero después de 3 a 4 semanas de tratamiento, la inflamación y después el dolor mejoraron. Cuando llegué a Boston (desde entonces mi ciudad favorita) para ver al Dr Stone, no podía caminar o ir al museo. Ayer, caminé casi todo el centro de Boston virtualmente libre de dolor, mientras pensaba que esto era un milagro.
Diagnóstico anatomopatológico:Vaculopatía mediada por linfocitos, con microtrombos de fibrina e hialinización vascular (vasculopatía livedoide) secundaria a LES
Traducido de:
Case 5-2009 — A 47-Year-Old Woman with a Rash and Numbness and Pain in the Legs
Daniela Kroshinsky, M.D., John H. Stone, M.D., M.P.H., Donald B. Bloch, M.D., and Alireza Sepehr, M.D
Volume 360: 711-720. February 12, 2009. Number 7
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
The New England Journal of Medicine
Source Information
From the Departments of Dermatology (D.K.); Rheumatology, Allergy, and Immunology (J.H.S., D.B.B.); and Pathology (A.S.), Massachusetts General Hospital; and the Departments of Dermatology (D.K.), Medicine (J.H.S., D.B.B.), and Pathology (A.S.), Harvard Medical School.
References
1) Gibbs MB, English JC III, Zirwas MJ. Livedo reticularis: an update. J Am Acad Dermatol 2005;52:1009-1019. [CrossRef][ISI][Medline]
2) Uthman IW, Khamashta MA. Livedo racemosa: a striking dermatological sign for the antiphospholipid syndrome. J Rheumatol 2006;33:2379-2382. [Free Full Text]
3) Maessen-Visch MB, Koedam MI, Hamulyák K, Neumann HA. Atrophie blanche. Int J Dermatol 1999;38:161-172. [CrossRef][ISI][Medline]
4) Alegre VA, Gastineau DA, Winkelmann RK. Skin lesions associated with circulating lupus anticoagulant. Br J Dermatol 1989;120:419-429. [CrossRef][ISI][Medline]
5) Fiorentino DF. Cutaneous vasculitis. J Am Acad Dermatol 2003;48:311-340. [CrossRef][ISI][Medline]
6) Ramos-Casals M, Nardi N, Lagrutta M, et al. Vasculitis in systemic lupus erythematosus: prevalence and clinical characteristics in 670 patients. Medicine (Baltimore) 2006;85:95-104. [CrossRef][Medline]
7) Gill JM, Quisel AM, Rocca PV, Walters DT. Diagnosis of systemic lupus erythematosus. Am Fam Physician 2003;68:2179-2186. [ISI][Medline]
8) Cross LS, Aslam A, Misbah SA. Antinuclear antibody-negative lupus as a distinct diagnostic entity -- does it no longer exist? QJM 2004;97:303-308. [Free Full Text]
9) Fox RI, Stern M, Michelson P. Update in Sjögren syndrome. Curr Opin Rheumatol 2000;12:391-398. [CrossRef][ISI][Medline]
10) Papiris SA, Tsonis IA, Moutsopoulos HM. Sjögren's syndrome. Semin Respir Crit Care Med 2007;28:459-471. [CrossRef][ISI][Medline]
11) Ramos-Casals M, Brito-Zerón P, Font J. The overlap of Sjögren's syndrome with other systemic autoimmune diseases. Semin Arthritis Rheum 2007;36:246-255. [CrossRef][ISI][Medline]
12) Anaya JM, Delgado-Vega AM, Castiblanco J. Genetic basis of Sjögren's syndrome: how strong is the evidence? Clin Dev Immunol 2006;13:209-222. [CrossRef][ISI][Medline]
13) Anaya JM, Tobon GJ, Vega P, Castiblanco J. Autoimmune disease aggregation in families with primary Sjögren's syndrome. J Rheumatol 2006;33:2227-2234. [Free Full Text]
14) Priori R, Medda E, Conti F, et al. Risk factors for Sjögren's syndrome: a case-control study. Clin Exp Rheumatol 2007;25:378-384. [ISI][Medline]
15) Diógenes MJ, Diógenes PC, de Morais Carneiro RM, Neto CC, Duarte FB, Holanda RR. Cutaneous manifestations associated with antiphospholipid antibodies. Int J Dermatol 2004;43:632-637. [CrossRef][ISI][Medline]
16) Baker WF Jr, Bick RL. The clinical spectrum of antiphospholipid syndrome. Hematol Oncol Clin North Am 2008;22:33-52. [CrossRef][ISI][Medline]
17) Sammaritano LR. Antiphospholipid syndrome. South Med J 2005;98:617-625. [CrossRef][ISI][Medline]
18) Krause I, Leibovici L, Blank M, Shoenfeld Y. Clusters of disease manifestations in patients with antiphospholipid syndrome demonstrated by factor analysis. Lupus 2007;16:176-180. [Free Full Text]
19) Daoud MS, Hutton KP, Gibson LE. Cutaneous periarteritis nodosa: a clinicopathological study of 79 cases. Br J Dermatol 1997;136:706-713. [CrossRef][ISI][Medline]
20) Cardoso R, Gonçalo M, Tellechea O, et al. Livedoid vasculopathy and hypercoagulability in a patient with primary Sjögren's syndrome. Int J Dermatol 2007;46:431-434. [CrossRef][ISI][Medline]
21) Callen JP. Livedoid vasculopathy: what it is and how the patient should be evaluated and treated. Arch Dermatol 2006;142:1481-1482. [Free Full Text]
22) Jorizzo JL. Livedoid vasculopathy: what is it? Arch Dermatol 1998;134:491-493. [Free Full Text]
23) Hairston BR, Davis MD, Pittelkow MR, Ahmed I. Livedoid vasculopathy: further evidence for procoagulant pathogenesis. Arch Dermatol 2006;142:1413-1418. [Free Full Text]
24) Arbuckle MR, McClain MT, Rubertone MV, et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med 2003;349:1526-1533. [Free Full Text]
25) Tan EM, Feltkamp TE, Smolen JS, et al. Range of antinuclear antibodies in "healthy" individuals. Arthritis Rheum 1997;40:1601-1611. [ISI][Medline]
26) Bonilla E, Francis L, Allam F, et al. Immunofluorescence microscopy is superior to fluorescent beads for detection of antinuclear antibody reactivity in systemic lupus erythematosus patients. Clin Immunol 2007;124:18-21. [CrossRef][ISI][Medline]
27) Nifli AP, Notas G, Mamoulaki M, et al. Comparison of a multiplex, bead-based fluorescent assay and immunofluorescence methods for the detection of ANA and ANCA autoantibodies in human serum. J Immunol Methods 2006;311:189-197. [CrossRef][ISI][Medline]
28) Meiss F, Marsch WC, Fischer M. Livedoid vasculopathy: the role of hyperhomocysteinemia and its simple therapeutic consequences. Eur J Dermatol 2006;16:159-162. [ISI][Medline]
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL