 Este es el frotis de sangre periférica de una paciente con Púrpura Trombocitopénica Trombótica. Las células rojas están fragmentadas y aparecen como esquistocitos(glóbulos rojos rotos). Algunos esquistocitos adoptan la forma de cascos(Helmet cells). Algunos glóbulos rojos adoptan la forma de esferocitos ya que lo que les quedó de membrana solo les alcanza para adoptar la forma ´de esferocito y no la forma bicóncava normal. Pueden aparecer algunos precursores rojos nucleados como expresión de liberación de formas inmaduras de la Médula Ósea. Y por supuesto hay trombocitopenia como dijo Marco. Las plaquetas están atrapadas en la microcirculación.
Este es el frotis de sangre periférica de una paciente con Púrpura Trombocitopénica Trombótica. Las células rojas están fragmentadas y aparecen como esquistocitos(glóbulos rojos rotos). Algunos esquistocitos adoptan la forma de cascos(Helmet cells). Algunos glóbulos rojos adoptan la forma de esferocitos ya que lo que les quedó de membrana solo les alcanza para adoptar la forma ´de esferocito y no la forma bicóncava normal. Pueden aparecer algunos precursores rojos nucleados como expresión de liberación de formas inmaduras de la Médula Ósea. Y por supuesto hay trombocitopenia como dijo Marco. Las plaquetas están atrapadas en la microcirculación.Espacio virtual creado para discutir casos clínicos, actualizar temas y comentar inquietudes relacionadas con la práctica de la Medicina Interna
sábado, 28 de junio de 2008
Cual es el diagnóstico? PTT (Helmet cells, esquistocitos)
 Este es el frotis de sangre periférica de una paciente con Púrpura Trombocitopénica Trombótica. Las células rojas están fragmentadas y aparecen como esquistocitos(glóbulos rojos rotos). Algunos esquistocitos adoptan la forma de cascos(Helmet cells). Algunos glóbulos rojos adoptan la forma de esferocitos ya que lo que les quedó de membrana solo les alcanza para adoptar la forma ´de esferocito y no la forma bicóncava normal. Pueden aparecer algunos precursores rojos nucleados como expresión de liberación de formas inmaduras de la Médula Ósea. Y por supuesto hay trombocitopenia como dijo Marco. Las plaquetas están atrapadas en la microcirculación.
Este es el frotis de sangre periférica de una paciente con Púrpura Trombocitopénica Trombótica. Las células rojas están fragmentadas y aparecen como esquistocitos(glóbulos rojos rotos). Algunos esquistocitos adoptan la forma de cascos(Helmet cells). Algunos glóbulos rojos adoptan la forma de esferocitos ya que lo que les quedó de membrana solo les alcanza para adoptar la forma ´de esferocito y no la forma bicóncava normal. Pueden aparecer algunos precursores rojos nucleados como expresión de liberación de formas inmaduras de la Médula Ósea. Y por supuesto hay trombocitopenia como dijo Marco. Las plaquetas están atrapadas en la microcirculación.miércoles, 25 de junio de 2008
Ateneo Hospital Pintos 25/06/08. Mujer de 20 años con precordialgia súbita severa.
 Paciente femenina 20 años
Paciente femenina 20 añosMotivo de Internación: precordialgia
Enfermedad actual: refiere la paciente que presentó un dolor agudo en la región precordial de comienzo súbito y coincidiendo con la deglución de un sorbo de gran volumen de una gaseosa, mientras se encontraba en una confitería bailable. El dolor tuvo máxima intensidad desde el comienzo (10/10), y duró con esas características 5 minutos para ir disminuyendo sin desaparecer completamente hasta la consulta en un centro asistencial. El dolor era transfixiante y con irradiación a ambos hombros, aumentaba con los movimientos respiratorios. No refería tos, resfrío ni cuadros respiratorios los días previos al episodio.
Antecedentes personales: no refiere. La madre (que la acompaña en la consulta) dice que ha tenido trastornos de alimentación con adelgazamiento en el último año. Niega bulimia.
Antecedentes familiares: sin importancia

Examen físico: Paciente adelgazada en regular estado general, BMI 17, facies dolorosa. Taquipnea (fcia respiratoria 25 x minuto), fcia cardiaca: 100 x minuto regular, afebril.
Examen físico: el único elemento positivo en el examen físico es un frote pleuropericárdico en región precordial, que se ausculta con gran dificultad debido a la limitación a la inspiración profunda que el dolor le provoca.
Se interna. Se solicita Rx y TAC de tórax (imágenes)
Laboratorio: Gr 4650000 Hb 11,3 Hto 41% Gb 11500 Ns 79% N en cayado 8%. ESD 48mm. Urea 48 mg%. Creatinina 1,1 mg%. Uricemia 4,5 mg%. Hepatograma sp. Sedimento de orina sp Latex AR neg FAN neg. PPD neg.
Electrocardiograma: taquicardia sinusal.
La paciente se internó en UTI con diagnóstico de perforación espontánea de esófago (Síndrome de Boerhaave), en base a la clínica de la paciente y a la presencia de neumomediastino en la Rx de Tórax con el signo de la V de Naclerio (despegamiento de la pleura mediastínica en el borde cardíaco izquierdo por aire en forma de V) y la TAC. Se le administró Piperacilina /Tazobactan + Vancomicina +Clindamicina EV, Clorhidrato de Morfina, hidratación parenteral, e
 volucionando con mejoría de los síntomas. La paciente se derivó a un instituto asistencial de La Plata donde se le realizó un tránsito de esófago con material de contraste hidrosoluble que mostró en la TAC: mínimo escape del contraste al mediastino. Se practicó una endoscopía digestiva alta que no mostró el lugar de la perforación, observándose una esofagitis de 1/3 inferior. Se decidió no intervenir quirúrgicamente a la paciente en forma inmediata y controlar de cerca el cuadro debido al buen estado general de la paciente a la buena evolución y a que se interpretó como una perforación mínima que podía ser pasible de tratamiento conservador. La paciente evolucionó sin fiebre y con excelente respuesta clínica por lo que fue externada al cabo de 2 semanas de tratamiento ATB con normalización de la Rx de tórax.
volucionando con mejoría de los síntomas. La paciente se derivó a un instituto asistencial de La Plata donde se le realizó un tránsito de esófago con material de contraste hidrosoluble que mostró en la TAC: mínimo escape del contraste al mediastino. Se practicó una endoscopía digestiva alta que no mostró el lugar de la perforación, observándose una esofagitis de 1/3 inferior. Se decidió no intervenir quirúrgicamente a la paciente en forma inmediata y controlar de cerca el cuadro debido al buen estado general de la paciente a la buena evolución y a que se interpretó como una perforación mínima que podía ser pasible de tratamiento conservador. La paciente evolucionó sin fiebre y con excelente respuesta clínica por lo que fue externada al cabo de 2 semanas de tratamiento ATB con normalización de la Rx de tórax.Conclusiones: se presentó una paciente de 20 años con dolor terebrante en región precordial baja, de aparición aguda, con acmé inicial y de intensidad máxima (10/10), y coincidiendo con la deglución de un sorbo de gran volumen de una gaseosa. La presencia de aire en mediastino en las imágenes confirma el diagnóstico de ruptura esofágica. En una charla a solas con la madre de la paciente esta admitió que había sido testigo de varios episodios de vómito prov
 ocado post ingesta.
ocado post ingesta.No sabemos si estos reiterados episodios de vómitos provocados puedan, a través de una esofagitis por reflujo haber condicionado al órgano ante la deglución de un gran volumen de una bebida gaseosa, a la penetración de un pequeño volumen de gas, a través de una perforación puntiforme no demostrada en la endoscopía , o directamente atravesando la pared esofágica por permeación en un momento de alta presión de la zona.
El diagnóstico diferencial más fuerte en este caso es el de Neumomediastino espontáneo, aunque la presencia de escape de medio de contraste en el esofagograma avalan el diagnóstico de SB.
De todas maneras la forma súbita de presentación, la coincidencia con el acto deglutorio, y la presencia de aire en el mediastino que desapareció en la evolución, nos autorizan a diagnosticar perforación espontánea de esófago, lo que configura un Síndrome de Boerhaave. El frote pleuropericárdico que presentaba la paciente probablemente se trate del "signo de Hamman", descripto por Louis Virgil Hamman MD del Johns Hopkins, y que se trata de un "crujido" que se ausculta en el precordio, sincrónico con el latido cardíaco y que es indicativo de neumomediastino espontáneo.
Es llamativa la buena evolución de la paciente sin cirugía y con tratamiento médico exclusivo. Pensamos que la buena evolución se debió a que la perforación de la pared esofágica fue mínima con cierre espontáneo inmediato y que eso permitió el pasaje de burbujas aéreas ingeridas con la gaseosa, además de un tratamiento ATB de amplio espectro administrado muy precozmente.
Síndrome de Boerhaave:
En 1724 el Dr Hermann Boerhaave describió el primer, y probablemente mejor conocido caso de perforación esofágica . El Barón von Wassenaer, el gran almirante holandés después de una gran comilona procedió a la emesis autoprovocada como era su costumbre luego de grandes excesos de alimentos y alcohol. Sin embargo en esta ocasión, el almirante experimentó un súbito y severo dolor en su abdomen superior después de una mínimamente productiva arcada. La muerte sucedió en menos de 24 hs, y su autopsia reveló un desgarro transversal del esófago distal y contenido gástrico en el espacio pleural. La ruptura espontánea de esófago es
 una rara pero peligrosa entidad que hoy día es conocida como Síndrome de Boerhaave
una rara pero peligrosa entidad que hoy día es conocida como Síndrome de BoerhaaveTípicamente ocurre luego del esfuerzo emético. El Síndrome de Boerhaave (SB) es una perforación transmural del esófago que debe distinguirse del Síndrome de Mallory- Weiss , o desgarro esofágico no transmural asociado a vómitos. Debido a que está asociado generalmente a vómitos, en realidad el SB no debiera llamarse verdaderamente espontáneo, sin embargo se sigue utilizando el término para distinguirlo de la perforación iatrogénica que es el 85/90% de las rupturas esofágicas.
El diagnóstico puede ser dificultoso a veces porque no siempre están todos los síntomas clásicos presentes, y el retraso a la consulta médica es frecuente. El reconocimiento temprano de esta condición potencialmente letal es vital en el pronóstico del paciente.. La mediastinitos, la sepsis y el shock son manifestaciones tardías de la enfermedad.
La mortalidad varía de acuerdo a las series pero es de aproximadamente 35%, constituyéndose en la perforación más letal de todo el tracto gastrointestinal. Los mejores resultados se ven con el diagnóstico temprano
Y la cirugía dentro de las 12 hs de de la ruptura. Si la cirugía es retrasada más de 24 hs la tasa de mortalidad aumenta a más de 50% y casi a 90% después de 48 hs. Sin tratamiento quirúrgico la mortalidad es cercana al 100%.
Patofisiología:La ruptura esofágica en el SB es postulada como el resultado de un aumento súbito en la presión intraesofágica producida durante el vómito, como resultado de una incoordinación motora causando fallo de relajación del músculo cricofaríngeo. El síndrome está asociado a excesos de ingesta alcohol y alimentos. El 50% de las ruptura espontáneas de esófago se da en pacientes con reflujo gastroesofágico, sugiriendo que la facilidad en transferencia de presiones del abdomen al tórax puede ser un factor condicionante. Asimismo se han reportado con frecuencia creciente las rupturas esofágicas en pacientes con bulimia o vómitos frecuentes de cualquier etiología. El lugar que con más frecuencia sufre el desgarro en el SB es la pared posterolateral izquierda del tercio inferior del esófago a 2 o 3 cm de la unión gastroesofágica. El segundo más común sitio de ruptura es en el esófago subdiafragmático.

Morbimortalidad:La tasa de mortalidad es alta. Es la más letal de las perforaciones del tracto gastrointestinal. La tasa de mortalidad es aproximadamente 30%, y la sobreviva es proporcional a la intervención quirúrgica temprana. La muerte se debe a infección que incluye: mediastinitis. neumonía, pericarditis o empiema. Los pacientes que se someten a intervención quirúrgica dentro de las 24 hs sobreviven 70 a 75%. Si la cirugía se retrasa mas de 24 hs la sobreviva cae a 35 -50% y a menos de 10% si se dilata a más de 48 hs. Los casos de sobreviva sin cirugía son raros, y motivo de publicación.
Clínica.La presentación clásica usualmente consiste en repetidos episodios de arcadas y vómitos, típicamente en un varón de edad media con reciente excesiva ingesta de alimentos y alcohol. Esto es seguido por inicio súbito de severo dolor en la parte baja del tórax o alta del abdomen. El dolor puede ser transfixiante o irradiarse al hombro, sobre todo al izquierdo. . La deglución agrava el dolor. La deglución puede precipitar accesos de tos por la comunicación del esófago con la cavidad pleural. . La taquipnea superficial es debida a dolor pleural.
La tríada de Mackler define la presentación clásica. Esta consiste en vómitos, dolor torácico bajo, y enfisema subcutáneo. Los pacientes con perforación de esófago pueden presentar dolor en cuello y parte superior del tórax. Los pacientes con perforación de esófago medio, pueden presentar dolor interescapular o epigástrico. EL derrame pleural es común. Si hay enfisema subcutáneo este es útil en confirmar el diagnóstico. Este se ve en 28 a 66% de los pacientes. Taquicardia, diaforesis, fiebre e hipotensión son comunes cuando la enfermedad progresa. Hallazgos inusuales incluyen: cianosis periférica, ronquera por compromiso del recurrente distensión venosa cervical, desviación de la traquea y mediastino, proptosis. El neumomediastino es un hallazgo muy importante. Este puede causar un sonido de tipo crujido llamado “el crujido de Hamman”, este coincide con el latido cardíaco, y puede se
 r confundido con frote pericárdico. Se ve en 20% de los pacientes
r confundido con frote pericárdico. Se ve en 20% de los pacientesDiagnóstico diferencial:Disección de aorta
Síndrome de Mallory Weiss
Infarto Agudo de Miocardio
Pancreatitis aguda
Úlcera péptica
Neumotórax
Imágenes:
Rx de tórax: es muy útil porque revela la perforación en 90% de los casos. El hallazgo mas prevalente es derrame pleural usualmente izquierdo. Puede haber neumotórax, neumomediastino, enfisema subcutáneo o ensanchamiento mediastínico. El signo de la V de Naclerio ha sido descrito en 20% de los pacientes. Este consiste en estrías de aire que disecan los planos faciales detrás del corazón con forma de la letra V. (ver imagen de Rx de tórax focalizada)
Esofagograma:Ayuda a confirmar el diagnóstico, y típicamente muestra extravasación de contraste en la cavidad pleural. El estudio sirve para localizar la perforación y elegir la vía de abordaje torácica o abdominal. El medio de contraste hidrosoluble tal como Gastrografina tiene 90% de sensibilidad. Hay un 20% de los pacientes que tienen falsos negativos. El uso de bario en pacientes con Síndrome de Boerhaave ha estado asociado a severa mediastinitos. Si el estudio con contraste es negativo y el índice de sospecha clínica sigue siendo alto colocar al paciente en decúbito lateral derecho y después izquierdo puede ser útil.
TAC:Puede revelar criterios diagnósticos decisivos. Es útil para pacientes demasiado comprometidos para tolerar un esofagograma, localiza la colección de líquido cuando existe para más adecuado drenaje quirúrgico
Procedimientos:
Endoscopía: no se usa habitualmente porque conlleva el riesgo adicional de aumentar el tamaño y extensión de la perforación forzando aire adicional al mediastino a la cavidad pleural, es más útil en las perforaciones del esófago torácico y tiene baja sensibilidad en el esófago cervical. La endoscopía puede ser útil cuando la perforación es sospechada pero no probada, especialmente cuando se sospecha perforación por cuerpo extraño.
Tratamiento:El manejo ideal comprende la combinación de medidas conservadoras como la intervención quirúrgica.
1) Administración de líquidos intravenosos. 2) Administración de ATB de amplio espectro. 3) Intervención quirúrgica temprana.
La decisión de medidas exclusivamente médicas conservadoras sin intervención quirúrgica, o más agresiva(médica más quirúrgica) depende de los siguientes factores: 1) Diagnóstico tardío 2) Tamaño de la perforación y 3) Condición médica del paciente.
Si bien la intervención quirúrgica es el procedimiento Standard, Cameron estableció una serie de criterios en los cuales el manejo puede ser exclusivamente médico: 1) la disrupción del esófago puede ser contenida al mediastino, 2) la cavidad está bien drenada al esófago, 3) el paciente está muy poco sintomático, 4) las evidencias clínicas de infección son mínimas.
En los casos de manejo conservador, se trata al paciente con Líquidos intravenosos, ATB (Imipenem/Cilastatin ofrece un buen espectro de cobertura), succión nasogástrica, adecuado drenaje con tubo de toracostomía, suplementación nutricional parenteral o e
 nteral por yeyunostomía.
nteral por yeyunostomía.Manejo quirúrgico:
La reparación directa de la ruptura y el adecuado drenaje del mediastino y la cavidad pleural proveen las mejores tasas de sobreviva. Una toracotomía izquierda es el approach preferido aunque la laparotomía puede ser necesaria si el desgarro se extiende al esófago distal.
Técnicas más nuevas incluyen el uso de stents autoexpandibles metálicos, aunque su uso en patologías no malignas es controversial porque no pueden ser extraídos una vez colocados. Actualmente el uso de stents en SB es recomendado para casos en que el diagnóstico se ha hecho tardíamente o fallos en el tratamiento conservador.
Bibliografía1) Mediastinal emphysema in an adolescent with anorexia nervosa and self-induced emesis.
Overby KJ, Litt IF.
Department of Pediatrics, Stanford University School of Medicine, California.
2) J Nippon Med Sch. 2006 Dec;73(6):
Boerhaave syndrome treated conservatively following early endoscopic diagnosis: a case report.
Matsuda A, Miyashita M, Sasajima K, Nomura T, Makino H, Matsutani T, Katsuno A, Sasaki J, Tajiri T.
3) Jpn J Thorac Cardiovasc Surg. 2000 Jul;48(7):473-5
Spontaneous esophageal rupture treated by conservative therapy.
Morimoto Y, Mukai T.
Department of Surgery, Chibune General Hospital, Osaka, Japan.
4) Helv Chir Acta. 1993 Sep;60(1-2):11-5.
[The value of conservative therapy, surgical treatment and interventional radiology in perforations and ruptures of the esophagus]
[Article in French]
Moser JJ, Seiler C, Wagner HE, Schweizer W, Czerniak A.
Klinik für Viszerale und Transplantationschirurgie, Inselspital B
5) Chest. 2005 Nov;128(5):3298-302.
Spontaneous pneumomediastinum: a benign curiosity or a significant problem?
Newcomb AE, Clarke CP.
Austin Hospital, Melbourne, VIC, Australia. anewcomb@amavic.com
6) J Pediatr Hematol Oncol. 2005 Nov;27(11):616-7
Conservative surgical treatment of a profoundly immunosuppressed pediatric patient with Boerhaave syndrome.
Lee TC, Dreyer ZE, Brandt ML.
7) Pediatrías. 1988 Jan;81(1):134-6.
Mediastinal emphysema in an adolescent with anorexia nervosa and self-induced emesis.
Overby KJ, Litt IF.
Department of Pediatrics, Stanford University School of Medicine, California
8) Z Gastroenterol. 1983 May;21(5):205-11.
[Incomplete spontaneous esophageal rupture - a variant of the Mallory-Weiss and Boerhaave syndrome?]
[Article in German]
Rösch W, Eifler R.
9) Altorjay A, Kiss J, Vörös A, Bohák A. Nonoperative management of esophageal perforations. Is it justified?. Ann Surg. Apr 1997;225(4):415-21. [Medline
Biopsia de Cerebro (H&E). Diagnóstico?
 Esto es una encefalopatía espongiforme del cerebro. En humanos esta enfermedad es mas a menudo manifestada como Enfermedad de Creutzfeldt-Jakob (CJD),una demencia rapidamente progresiva.
Esto es una encefalopatía espongiforme del cerebro. En humanos esta enfermedad es mas a menudo manifestada como Enfermedad de Creutzfeldt-Jakob (CJD),una demencia rapidamente progresiva.Histológicamente hay pequeños huecos en el parénquima cerebral (cambios espongiformes) vistos con H&E.
Esta enfermedad es producida por Proteínas Priónicas tal cual lo expresara Marco en su comentario.
Por ello, Marco se hace acreedor de las felicitaciones del blog
The University of Utah Eccles Health Sciences Library
martes, 24 de junio de 2008
Paciente masculino de 25 años con tumoración lateral de cuello, de varios años de evolución.Diagnóstico ?
 Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.
Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.Estas lesiones pueden crecer lentamente con el tiempo causando malestar local. En ocasiones pueden infectarse
Son fácilmente escindidos. Si el epitelio de la lesion es maligno podría tratarse de una metástasis ganglionar de un carcinoma escamoso.
En el Diagnóstico por Imágenes, los quistes se presentan como estructuras de pared fina, regular y rellenas de líquido seroso o mucinoso, que típicamente no muestran realce tras en contraste e.v. Si se infectan, la pared presenta realce y aumenta de grosor; transformándose el contenido en proteináceo, y los tejido
 s circundantes edematosos. El líquido puede variar entre hipointenso a isointenso en T1, en RM e hiperintenso en secuencias T2 (hipodenso ci. isodenso en TC; desde anecogénico a hiperecogénico en ecografía, pudiendo simular una masa sólida o particulada).Los quistes del 2do arco aparecen típicamente por delante del músculo esternocleidomastoideo (ECM), cerca del ángulo mandibular, si bien pueden aparecer en cualquier lugar del trayecto de una fístula o de un seno del 2do arco branquial, e incluso expandirse hasta el triángulo posterior del cuello. La extensión de una masa entre la arteria carótida externa e interna es sugerente de un quiste de 2do arco independientemente de su relación con el ECM
s circundantes edematosos. El líquido puede variar entre hipointenso a isointenso en T1, en RM e hiperintenso en secuencias T2 (hipodenso ci. isodenso en TC; desde anecogénico a hiperecogénico en ecografía, pudiendo simular una masa sólida o particulada).Los quistes del 2do arco aparecen típicamente por delante del músculo esternocleidomastoideo (ECM), cerca del ángulo mandibular, si bien pueden aparecer en cualquier lugar del trayecto de una fístula o de un seno del 2do arco branquial, e incluso expandirse hasta el triángulo posterior del cuello. La extensión de una masa entre la arteria carótida externa e interna es sugerente de un quiste de 2do arco independientemente de su relación con el ECMBibliografía
1) The University of Utah Eccles Health Sciences Library
2) Benson, Manferd; Dalen, Kenneth; Mancuso, Anthony et al. Congenital Anomalies of the Branchial Apparatus: 3) Embryology and Pathologic Anatomy. Radiographics 1992, Vol. 12, NS, pag. 943.- Zadvinskis ' David; Benson, Manferd; Kerr, Hugh. et al. Congenital Malformation of the Cervico-thoracic Lymphatic System: Embryology and Pathogenesis. Rcidiographics: 1992, Vol. 12, NS, pag. 1175.- Badami, J.; Athey, R et al. US in the Diagnostic of Branchial Cyst. AJR1981, 137:1245.- Ahuja, A; Chang, A; Pang, P. Branchial Cyst. Sonographics features. AJNR: 2000, 21:1340.- Taher, M; Wood, A; Chan, 0. et al. Unusual MR. Appearance in a Branchial Cyst. Clin Radiol 1999, 54:263- 4) Lee, Joseph; Stanley, Robert; Sagel, Stuart et al. Body CT and MR1 correlation. Lippincott-Raven, 1998; pag 162-164
5) Revista de la Asociación Médica Argentina
lunes, 23 de junio de 2008
Masa duodenal e imágenes hepáticas. Diagnóstico?

La TAC muestra una masa en duodeno así como metástasis hepáticas y la imagen de la microscopía muestra clusters de células bastante uniformes en su morfología. La tinción inmunohistoquímica fue positiva para diferenciación neuroendócrina.
Se trata de un tumor carcinoide. El paciente tenía síndrome carcinoide con diarrea rash cutáneo en cara, sibilancias y disnea esporádicas, hipotensión, palpitaciones, fatiga y debilidad.Tenía además esclerosis valvular tricuspídea con fallo cardíaco derecho.
El tumor producía 5 Hidroxitriptamina que se transformaba en 5 Hidroxiindolac
 ético(5HIAA)। Además tenía dosages altos de Cromogranina, Histamina Bradikinina, Enolasa neurona específica y calcitonina.
ético(5HIAA)। Además tenía dosages altos de Cromogranina, Histamina Bradikinina, Enolasa neurona específica y calcitonina.Bibliografía
The University of Utah Eccles Health Sciences Library
domingo, 22 de junio de 2008
Porqué Palindrómico?
El Reumatismo Palindrómico (RP), también conocido como síndrome de Hench-Rosenberg, es un cuadro reumatológico caracterizado por episodios de artritis intermitente, recurrente o recidivante. Además de las artritis cristálicas (las causas más frecuentes de artritis recurrentes), hay varias condiciones que pueden presentarse clínicamente como monoartritis o poliartritis intermitentes. El Reumatismo Palindrómico es el paradigma de este tipo de cuadros, aunque otras entidades como la Enfermedad de Whipple, la Artitis asociada a Hiperlipemia, la Hidrartrosis intermitente, deben ser tenidos en cuenta en el diagnóstico diferencial de artritis recurrente.
El término “palindrómico” deriva del griego (del griego palin dromein, volver a ir hacia atrás)y es una palabra, número o frase que se lee igual hacia adelante que hacia atrás. Si se trata de un número, se llama capicúa.
La aplicación de este término a esta enfermedad reumatológica se debe a que son cuadros que “se van como vinieron”, (“comes and goes”) y sin dejar generalmente secuelas de una manera similar a las cristálicas. Puede afectar una articulación o varias en forma simultánea o sucesiva
El cuadro clásico de este síndrome consiste en la aparición súbita de un cuadro de artritis o periartritis afebril, que puede durar horas o días y desaparece de la misma manera en que apreció, súbitamente. . Hay durante el episodio dolor de moderada a gran intensidad, rubicundez, tumefacción y calor en la o las articulaciones comprometidas. El intervalo entre los ataques es extremadamente variable, de días a meses o años. Como dijimos no deja secuelas clínicas ni radiológicas.
Algunos pacientes han evolucionado a AR o a otras enfermedades autoinmunes en la evolución.
Algunos ejemplos de palíndromos: (haga la prueba de leer las frases en ambos sentidos)
Acaso hubo búhos acá? (de Juan Filloy)
Adivina ya te opina, ya ni miles origina, ya ni cetro me domina, ya ni monarcas, a repaso ni mulato carreta, acaso nicotina, ya ni cita vecino, anima cocina, pedazo gallina, cedazo terso nos retoza de canilla goza, de pánico camina, ónice vaticina, ya ni tocino saca, a terracota luminosa pera, sacra nómina y ánimo de mortecina, ya ni giros elimina, ya ni poeta, ya ni vida. (de Ricardo Ochoa)
Allí por la tropa portado, traído a ese paraje de maniobras, una tipa como capitán usar boina me dejara, pese a odiar toda tropa por tal ropilla. (de Luis Torrent)
Allí si María avisa y así va a ir a mi silla. (HG)
Anita la gorda lagartona no traga la droga latina.
Anita lava la tina. (Popular en México)
Átale, demoníaco Caín, o me delata. (de Julio Cortázar)
Dábale arroz a la zorra el abad. (tal vez uno de los más populares)
La ruta nos aportó otro paso natural.
Nada, yo soy Adán. (Guillermo Cabrera Infante)
No lata, no: la totalidad arada dilato talón a talón. (Juan Filloy)
No solo no lo son. (título de una canción del grupo Mano de Santo)
Se lo creí, mareada. Era miércoles. (de Luciana Rezzónico)
Sé verlas al revés. (de Diego Vidal)
Bibliografía
1)Palindromic rheumatism: different genetic background implies a distinct disease entity.
Kim SK, Lee HS, Lee KW, Bae SC, Jun JB.
2) Palindromic rheumatism and other relapsing arthritis.
Sanmarti R, Cañete JD, Salvador G.
3) Wikipedia
4) A patient with severe palindromic rheumatism and frequent episodes of pain.
Takata S, Harada S, Mitsunobu F, Mifune T, Hosaki Y, Asida K, Tsugeno H, Okamoto M, Iwahashi M, Kawashima M, Yamamura M, Makino H, Tanizaki Y.
Intern Med. 2001 Feb;40(2):140-3
El término “palindrómico” deriva del griego (del griego palin dromein, volver a ir hacia atrás)y es una palabra, número o frase que se lee igual hacia adelante que hacia atrás. Si se trata de un número, se llama capicúa.
La aplicación de este término a esta enfermedad reumatológica se debe a que son cuadros que “se van como vinieron”, (“comes and goes”) y sin dejar generalmente secuelas de una manera similar a las cristálicas. Puede afectar una articulación o varias en forma simultánea o sucesiva
El cuadro clásico de este síndrome consiste en la aparición súbita de un cuadro de artritis o periartritis afebril, que puede durar horas o días y desaparece de la misma manera en que apreció, súbitamente. . Hay durante el episodio dolor de moderada a gran intensidad, rubicundez, tumefacción y calor en la o las articulaciones comprometidas. El intervalo entre los ataques es extremadamente variable, de días a meses o años. Como dijimos no deja secuelas clínicas ni radiológicas.
Algunos pacientes han evolucionado a AR o a otras enfermedades autoinmunes en la evolución.
Algunos ejemplos de palíndromos: (haga la prueba de leer las frases en ambos sentidos)
Acaso hubo búhos acá? (de Juan Filloy)
Adivina ya te opina, ya ni miles origina, ya ni cetro me domina, ya ni monarcas, a repaso ni mulato carreta, acaso nicotina, ya ni cita vecino, anima cocina, pedazo gallina, cedazo terso nos retoza de canilla goza, de pánico camina, ónice vaticina, ya ni tocino saca, a terracota luminosa pera, sacra nómina y ánimo de mortecina, ya ni giros elimina, ya ni poeta, ya ni vida. (de Ricardo Ochoa)
Allí por la tropa portado, traído a ese paraje de maniobras, una tipa como capitán usar boina me dejara, pese a odiar toda tropa por tal ropilla. (de Luis Torrent)
Allí si María avisa y así va a ir a mi silla. (HG)
Anita la gorda lagartona no traga la droga latina.
Anita lava la tina. (Popular en México)
Átale, demoníaco Caín, o me delata. (de Julio Cortázar)
Dábale arroz a la zorra el abad. (tal vez uno de los más populares)
La ruta nos aportó otro paso natural.
Nada, yo soy Adán. (Guillermo Cabrera Infante)
No lata, no: la totalidad arada dilato talón a talón. (Juan Filloy)
No solo no lo son. (título de una canción del grupo Mano de Santo)
Se lo creí, mareada. Era miércoles. (de Luciana Rezzónico)
Sé verlas al revés. (de Diego Vidal)
Bibliografía
1)Palindromic rheumatism: different genetic background implies a distinct disease entity.
Kim SK, Lee HS, Lee KW, Bae SC, Jun JB.
2) Palindromic rheumatism and other relapsing arthritis.
Sanmarti R, Cañete JD, Salvador G.
3) Wikipedia
4) A patient with severe palindromic rheumatism and frequent episodes of pain.
Takata S, Harada S, Mitsunobu F, Mifune T, Hosaki Y, Asida K, Tsugeno H, Okamoto M, Iwahashi M, Kawashima M, Yamamura M, Makino H, Tanizaki Y.
Intern Med. 2001 Feb;40(2):140-3
miércoles, 18 de junio de 2008
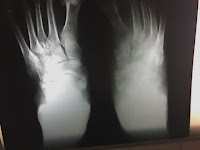
Ateneo Hospital Pintos 18/06/08. Mujer de 46 años con dolor en pie de 1 año de evolución
 Paciente femenina Edad: 46 añosFecha de consulta: Abril del 2007Motivo de consulta: dolor en cara interna de pie izquierdo
Paciente femenina Edad: 46 añosFecha de consulta: Abril del 2007Motivo de consulta: dolor en cara interna de pie izquierdoAntecedentes: no presenta
Enfermedad actual: dolor en cara interna de pie izquierdo que apareció post esfuerzo de 1 mes de evolución que limitaba la deambulación. Es evaluada por medico clínico quien diagnostica tendinitis e indica tto con aines al que no responde por lo que es derivada al Servicio de Traumatología quienes confirman diagnóstico e indican aines im, calor y reposo.
Ante la falta de respuesta al tratamiento consulta nuevamente con otro Traumatólogo quien solicita Rx. Pie izquierdo que presenta signos de osteoporosis, indicándole venda elástica, kinesioterapia, aines y calcio.
La paciente persiste sintomática asociándose una tumefacción en dorso de pie por lo que consulta y le realizan una ecografía de partes blandas en la que se observa edema del TCS sin colección. Indican aines y reposo.Ante la falta de respuesta la paciente consulta con un especialista en Traumatología en la ciudad de La Plata
Traumatología: solicitan nueva Rx. Ambos pies (Octubre 2007) y laboratorio con ERS 61mm/h. En la Rx comparativa de ambos pies se observa una diferencia notable de densidades óseas a expensas de un proceso osteolítico que involucra huesos del tarso, cuñas y escafoides con tumefacción de partes blandas. Por todo ello y ante la persistencia de la sintomatología se decide la exploración quirúrgicaCirugía: se constató durante el procedimiento un proceso inflamatorio inespecífico, se debridó la zona y se envía para anatomía patológica y cultivos.
Anatomía Patológica: Proceso inflamatorio granulomatoso necrotizante deshabitado.Cultivos: negativos, BAAR negativo.
Sigue con tratamiento con Aines y kinesioterapia con mala respuesta y empeoramiento de la sintomatología por lo que se decide realizar TAC de la zona
TAC(02/08): signos de osteólisis de huesos tarsianos involucrando cuñas y escafoides con importante componente de partes blandas periféricas (proceso osteolítico infeccioso?)
Centellograma oseo Tc99 (02/08): hiperactividad en sector lateral de tarso izquierdo que persiste en las imágenes de 24 horas. Hiperflujo e hiperemia de la zona. Hipercaptación difusa en pie derecho, probablemente originada por alteración de la marchaLaboratorio: ERS 90mm/h
Anatomía patológica (03/08):(material intraóseo, cortical y partes blandas)Cuadro de proceso inflamatorio crónico granulomatoso observable en AR,Fiebre Reumática y LESCultivos: negativos
Hasta este momento es de hacer notar que después de un año de evolución del proceso, la paciente presentó siempre buen estado general, ausencia de manifestaciones sistémicas como fiebre, sudoración, adelgazamiento, compromiso de piel o mucosas, prurito, articulaciones o partes blandas a excepción del pié izquierdo, nódulos subcutáneos etc.
Tampoco refiere viajes a zonas exóticas en los últimos años
No se le realizaron análisis mas allá de Hemogramas( que siempre fueron normales) y VSG que estaba elevada según consta.
La paciente fue vista durante este año de evolución por especialistas en Traumatología y Ortopedia, y solo después de que se recibe la Anatomía Patológica por Reumatólogos
Se presentó la paciente en Ateneo para discusión diagnóstica, plan de estud
 io y eventuales tratamientos
io y eventuales tratamientosA la paciente se le solicitó laboratorio completo con colagenograma (FAN, Anca, Rose Ragan, etc) siendo todos negativos
Rx. Tórax: acentuación de la trama intersticial en ambos campos pulmonaresRx. Pie izquierdo: rarefacción óseaPPD(04/08): 20mm diámetro y 3mm elevación
Se solicita TAC de Tórax que muestra severa intersticiopatía bilateral que en el contexto de la paciente con antecedentes de proceso granulomatoso óseo en pie y PPD hiperérgica, se propone iniciar tratamiento antituberculoso.La paciente vuelve a ciudad de orígen y comienza con vómitos alimentarios,fiebre de 40ºC y cefalea intensa con rápida progresión en horas a diplopía y deterioro del sensorio por lo que se interna en UTI, donde se constata síndrome meníngeo franco.
Se realiza punción lumbar: que mostró un aumento de celularidad con predominio linfocitario aumento de las proteínas y descenso leve de la glucorraquia(lamentablemente no figuran los resultados del estudio físico químico), interpretándose como meningitis Tuberculosa
Se realiza RMN y TAC que muestra numerosas imágenes nodulares tanto supra como infratentoriales compatibles con granulomas tuberculosos
HIV negativo
Cultivo del material del absceso óseo para BAAR positivo al cabo de 90 días.
Se inicia tratamiento tuberculostático por sonda nasogástrica, con lo que comienza una lenta mejoría del cuadro clínico, recuperación del estado de conciencia, y correción de los parámetros humorales
Al cabo de 2 meses de tratamiento la paciente presenta una notable mejoría sin secuelas neurológicas
Tuberculosis
Es la causa infecciosa que mas muertes produce en el planeta. La OMS estima que 2 billones de pacientes tienen TBC latente y que 3 millones mueren por la enfermedad en todo el mundo
Patofisiología
Los humanos son los únicos reservorios conocidos para Mycobacterium tuberculosis. Se transmite por vía aérea por las llamadas “droplet nuclei”(microgotas), de aproximadamente 1 a 5 micrones de diámetro. Cada una de ellas puede tener 10 bacilos. Pueden permanecer suspendidas en el aire por varias horas dependiendo del medio ambiente. Estas microgotas son generadas durante la conversación la tos y el estornudo. Un único episodio de tos puede generar 3000 microgotas. Hablar 5 minutos 3000 microgotas cantar durante 1 minuto 3000 microgotas. El estornudo es lejos la forma más eficiente de generar microgotas (decenas de miles) que pueden diseminarse 3 metros a la redonda. Los bacilos que entran así al aparato respiratorio llegan a los espacios aéreos del pulmón, son fagocitados por los macrófagos y conducidos a los linfáticos regionales, teniendo 4 posibilidades o destinos: 1) pueden ser destruidos por el sistema inmune, 2) pueden comenzar a multiplicarse y causar TBC primaria, 3) pueden pasar al estado de latencia y permanecer “dormidos” y 4) pueden proliferar después de un período de latencia (enfermedad de reactivación)
Una vez que el bacilo de Koch entra al organismo hay una etapa en la que todavía la inmunidad celular no ha generado el desarrollo de linfocitos específicos, y se produce entonces la llamada diseminación postprimaria del microorganismo. Son así afectados en esta pr
 ecoz etapa de la enfermedad los diferentes órganos como la corteza renal, los ganglios linfáticos, los plexos coroideos, las metáfisis óseas, los ovarios y las trompas etc. Una vez que la inmunidad celular específica se hace presente estas pequeñas comunidades de bacilos quedan acantonados de por vida dentro de las células en los diversos tejidos, viviendo en forma latente, con escasa actividad metabólica, la mayoría de las veces en forma definitiva sin expresarse clínicamente nunca en la vida del individuo. Cuando por cualquier motivo la inmunidad disminuye su efectividad alguno de estos focos puede reactivarse y comenzar a proliferar produciendo una forma secundaria de Tuberculosis, en cualquier localización (renal, ganglionar, osteoarticular, m
ecoz etapa de la enfermedad los diferentes órganos como la corteza renal, los ganglios linfáticos, los plexos coroideos, las metáfisis óseas, los ovarios y las trompas etc. Una vez que la inmunidad celular específica se hace presente estas pequeñas comunidades de bacilos quedan acantonados de por vida dentro de las células en los diversos tejidos, viviendo en forma latente, con escasa actividad metabólica, la mayoría de las veces en forma definitiva sin expresarse clínicamente nunca en la vida del individuo. Cuando por cualquier motivo la inmunidad disminuye su efectividad alguno de estos focos puede reactivarse y comenzar a proliferar produciendo una forma secundaria de Tuberculosis, en cualquier localización (renal, ganglionar, osteoarticular, m eníngea, peritoneal etc).
eníngea, peritoneal etc).Clínica
No nos detendremos en este resumen a describir las manifestaciones de la TBC en los distintos sistemas que puede afectar pero si haremos hincapié en la forma osteoarticular, y de SNC que son, además de la forma pulmonar las que presentó nuestra paciente.
Tuberculosis ósea:
En la década del 80 después de una firme declinación en la incidencia en las décadas anteriores hubo un resurgimiento de la Tuberculosis en general y de la osteoarticular en particular coincidiendo con la aparición del Sida. El patrón de manifestaciones extrapulmonares en general ha cambiado con una mayor incidencia de las mismas (pleural, ganglionar y osteoarticular) y con mayor dificultad para el diagnóstico de las mismas, para lo que se requiere un alto índice de sospecha. Por otro lado, una vez obtenidas las muestras de tejido para estudios diagnósticos, la ausencia frecuente de granulomas, y la ausencia de desarrollo de Mycobacterium tuberculosis no debe descartar la presencia de la enfermedad, para lo que hoy se cuenta con metodología diagnóstica de gran ayuda como niveles de adenosin deaminasa(ADA), y PCR casi imprescindibles para el diagnóstico de TBC extrapulmonar.
La Tuberculosis ósea es una forma de Tuberculosis secundaria producida por la reactivación de un foco óseo sembrado en la etapa de diseminación posprimaria, a veces muchos años después de producida la misma.
El sitio mas común de afectación en la TBC osteoarticular es la columna vertebral (Mal de Pott). Cuyos síntomas incluyen lumbalgia o rigidez dorsolumbar, parálisis en miembr
 os inferiores en pacientes con diagnóstico tardío. Alrededor del 50% de los casos de TBC osteoarticular es extraespinal. La artritis Tuberculosa usualmente afecta una sola articulación. Aunque cualquier articulación puede verse afectada la cadera y la rodilla son las más frecuentemente comprometidas, seguidas por el tobillo, muñeca y hombro. El dolor puede preceder a los cambios radiográficos por semanas a meses. El compromiso de múltiples sitios no es común. Las lesiones óseas puras pueden ser silentes hasta que haya alguna complicación tal como fractura por compresión del hueso, compromiso de tejidos vecinos o formación de abscesos fríos que se pueden drenar espontáneamente a la superficie de la piel. Las lesiones óseas son comúnmente vistas como periostitis o formación de lesiones quísticas. A veces cuando la TBC es multicéntrica presentándose como lesiones osteolíticas requiere hacer diagnóstico diferencial con Mieloma Múltiple, metástasis óseas, u osteomielitis. Otros diagnósticos diferenciales de estas lesiones incluyen Gota, Actinomicosis, Coccidioidomicosis, Maduromicosis, Criptococosis Sífilis etc.
os inferiores en pacientes con diagnóstico tardío. Alrededor del 50% de los casos de TBC osteoarticular es extraespinal. La artritis Tuberculosa usualmente afecta una sola articulación. Aunque cualquier articulación puede verse afectada la cadera y la rodilla son las más frecuentemente comprometidas, seguidas por el tobillo, muñeca y hombro. El dolor puede preceder a los cambios radiográficos por semanas a meses. El compromiso de múltiples sitios no es común. Las lesiones óseas puras pueden ser silentes hasta que haya alguna complicación tal como fractura por compresión del hueso, compromiso de tejidos vecinos o formación de abscesos fríos que se pueden drenar espontáneamente a la superficie de la piel. Las lesiones óseas son comúnmente vistas como periostitis o formación de lesiones quísticas. A veces cuando la TBC es multicéntrica presentándose como lesiones osteolíticas requiere hacer diagnóstico diferencial con Mieloma Múltiple, metástasis óseas, u osteomielitis. Otros diagnósticos diferenciales de estas lesiones incluyen Gota, Actinomicosis, Coccidioidomicosis, Maduromicosis, Criptococosis Sífilis etc.Una PPD positiva y una VSG acelerada son importantes pistas para pensar en TBC, sin embargo la PPD puede ser negativa en 10% , y el mismo porcentaje pueden tener VSG normal!!!
El diagnóstico definitivo depende de la punción aspiración con aguja bajo control radiográfico, ecográfico o por TAC , con el procesamiento adecuado de las muestras para exámenes histopatológicos cultivos, inoculación a cobayos etc. El cultivo tradicional de las micobacterias requieren varias semanas para el desarrollo e identificación. Nuevas tecnologías incluyen sondas ribosomales de RNA o PCR de DNA que permiten la identificación dentro de las 24 hs. Los métodos de cultivos radiométricos (Bactec), permiten obtener de
 sarrollos en tiempos mucho más cortos.
sarrollos en tiempos mucho más cortos.Siempre hay que obtener muestras de sangre para realizar estudios de serología para HIV
Tuberculosis de SNC
Patofisiología: en la etapa de diseminación posprimaria los bacilos tuberculosos siembran las meninges o el parénquima cerebral resultando en la formación de pequeños focos subpiales o subependimarios, que pueden pasar a la fase latente por mucho tiempo. Estos focos llamados focos de Rich son los focos de reactivación en el caso de Meningitis Tuberculosa. La diseminación al SNC es mas probable si el paciente desarrolla una TBC miliar. Una vez producidos los focos de Rich, en el paciente con Meningitis Tuberculosa, se produce un crecimiento de estos focos con aumento de tamaño de los mismos hasta que se rompen al espacio subaracnoideo causando la meningitis, mientras que los focos de bacilos mas profundos en el cerebro o en la médula causan tuberculomas o abscesos cerebrales tuberculosos. Estos abscesos pueden romperse a los ventrículos, no así los focos de Rich
Un grueso y gelatinoso exudado infiltra los vasos meníngeos y corticales produciendo inflamación (vasculitis), obstrucción o infartos. La meningitis basilar da cuenta de la afectación de los pares craneales III, VI y VII, conduciendo eventualmente a hidrocéfalo obstructivo por obstrucción de las cisternas basales. Los procesos patológicos subsecuentes son la formación
 de adherencias, la vasculitis obliterativa y la encefalitis o mielitis.
de adherencias, la vasculitis obliterativa y la encefalitis o mielitis.Los tuberculomas son conglomerados caseosos en el cerebro centralmente localizados, que pueden alcanzar gran tamaños sin producir meningitis. Bajo condiciones de inmunodepresión severa pueden evolucionar a areas de cerebritis o francos abscesos cerebrales, pero el curso usual es hacia la coalescencia de focos caseosos y encapsulación fibrosa. A veces el tuberculoma se forma paradójicamente cuando el paciente está bajo tratamiento antituberculoso y antiretroviral como expresión de reconstitución inmune.
La meningitis espinal puede ser consecuencia de diseminación de meningitis intracraneal, como resultado de ruptura de un foco de Rich primario en la superficie de la médula rompiéndose al espacio subaracnoideo, o por extensión transdural a punto de partida de un foco óseo de espondilitis tuberculosa (Pott) Las lesiones a este nivel son las mismas que a nivel intracraneal, con vasculitis, evolución a infartos etc.
Las lesiones óseas precoces en la vértebra son invariablemente debidas a diseminación hematógena afectando a menudo la vértebra cerca del disco intervertebral. El disco está casi siempre afectado por la progresión de la enfermedad y a su través se afecta la vértebra adyacente junto a los ligamentos longitudinales anterior y posterior. Rapidamente desarrolla un absceso frío ya sea paraespinal en la región dorsolumbar o como absceso retrofaringeo en la región cervical. A medida que la enfermedad progresa el aumento de la descalcificación y erosión resultan en una colapso óseo progresivo con destrucción de los discos intervertebrales que afectan tanto como 3 a 10 vértebras en una lesión ocasionando una severa c
 ifosis al paciente. El absceso puede romperse al compartimiento intraespinal ocasionando una meningitis espinal primaria, una peripaquimeningitis hiperplásica, un absceso intraespinal o un tuberculoma espinal.
ifosis al paciente. El absceso puede romperse al compartimiento intraespinal ocasionando una meningitis espinal primaria, una peripaquimeningitis hiperplásica, un absceso intraespinal o un tuberculoma espinal.Efectos patológicos: el edema de papila es el efecto visual mas común en la Meningitis Tuberculosa pudiendo progresar a atrofia óptica y ceguera por compromiso directo del nervio óptico y del quiasma por exudados basales (aracnoiditis optoquiasmática).Otras causas de afectación visual son la corioretinitis, neuritis óptica, oftalmoplejía internuclear, y aveces hay inicio abrupto de oftalmoplejía dolorosa.
Los pares craneales mas frecuentemente afectados por la Meningitis Tuberculosa son el VI(el mas prevalente), III, IV, VII y menos frecuentemente el II, VIII, X, y XII.
El súbito inicio de déficits neurológicos incluyen monoplejías, hemiplejías, afasia y tetraparesia. Aunque a veces son manifestaciones de fenómenos post ictales (parálisis de Todd), la mayoría de las veces son debidas a cambios vasculíticos que resultan en focos isquémicos. Mientras algunos de estos cuadros pueden ser también expresión de aracnoiditis proliferativa o hidrocéfalo secundario, las vasculitis parecen ser la causa principal de los mismos. La vasculitis con trombosis e infarto hemorrágico puede afectar vasos que atraviesan la zona de base de cráneo o la región espinal, afecta la corteza o la profundidad del parénquima. Mycobacterium Tuberculosis también invade la adventicia directamente e inicia el proceso vasculítico. Una reacción neutrofílica temprana es seguida por infiltración de linfocitos, células plasmáticas y macrófagos conduciendo a la destrucción progresiva de la adventicia, disrupción de las fibras elásticas y finalmente destrucción de la íntima. Eventualmente la degeneración fibrinoide dentro de pequeñas arterias y venas produce aneurismas, múltiples trombos y hemorragias focales, solas o en combinación. El temblor es el trastorno de movimiento más común en el curso de la Meningitis Tuberculosa. En un pequeño porcentaje de los pacientes hay coreoatetosis y hemibalismo. Además, mioclonus y disfunción cerebelosa han sido observados. Estos trastornos del movimien
 to se ven en pacientes que tienen lesiones vasculares profundas.
to se ven en pacientes que tienen lesiones vasculares profundas.La Tuberculosis Meníngea es difícil de diagnosticar, y es importante un alto índice de sospecha para hacer un diagnóstico temprano. Es importante el interrogatorio sobre historia social , incluyendo recientes contactos con pacientes tuberculosos. Interrogar sobre estudios positivos de PPD sobre todo seroconversión reciente. Determinar si hay historia de inmunosupresión por enfermedad conocida o por tratamientos con ciertas drogas como uso e corticosteroides.. Chequear si hay historia negativa de vacunación BCG.
Usualmente el pródromo es inespecífico, e incluye cefalea, vómitos, fotofobia y fiebre. En una serie importante solo dos pacientes presentaron síntomas meningíticos. La duración de los síntomas de presentación pueden durar desde 1 día a 9 meses, aunque el 55% se presentó con síntomas de menos de 2 semanas de duración.
En los inmunocompetentes la TBC de SNC usualmente toma la forma de meningitis que causa una enfermedad aguda a subaguda caracterizada por fiebre, cefalea, malestar meningismo, confusión en un período de 2 a 3 semanas.
Durante el período prodrómico hay síntomas inespecíficos que incluyen fatiga, malestar, mialgia y fiebre. A menudo en el primer estadio de meningitis los pacientes tienen infección de vías aéreas superiores, hecho que debe recordarse cada vez que fiebre e irritabilidad o letargia parezcan fuera de proporción para un cuadro de VAS, o que persistan los síntomas generales después de la mejoría del cuadro respiratorio. Fiebre y cefalea pueden estar ausentes en tanto como el 25% de los pacientes y el malestar general puede faltar en el 60% de los casos. La cefalea y los cambios en el estado mental son comunes en los ancianos.
Los trastornos visuales incluyen pérdida de visión hasta la ceguera y ocasionalmente inicio abrupto de oftalmoplejía dolorosa.
Déficit neurológicos focales como monoplejía, hemiplejía, afasia y tetraparesia han sido reportados.
Temblor y movimientos anormales ya han sido descriptos.
El Síndrome de Secreción inadecuada de Hormona Antidiurética (SIADH) es una complicación común asociada a mal pronóstico.
Presentaciones menos frecuentes incluyen convulsiones febriles en niños, parálisis de nervios craneales aisladas, edema de papila bilateral y estado confusional.
La meningitis Tuberculosa espinal puede manifestarse de una forma aguda o crónica. La forma e meningitis espinal primaria es caracterizad a menudo por mielopatía con parálisis ascendente que progresa a parálisis ascendente. A veces debuta el cuadro como una paraplejía aguda con retención urinaria que mimetizan un Síndrome de Guillain Barre o una Mielitis Transversa.
La forma subaguda es a menudo caracterizada por mieloradiculopatía con dolor radicular, y paraplejía o tetraplejía progresivas.
Una forma mas crónica, menos agresiva, mimetiza un síndrome compresivo de lenta evolución o una aracnoiditis inespecífica.
Conclusiones: se presentó una paciente de 46 años con un cuadro doloroso de un año de evolución, en región de tarso de pie izquierdo que cursó con descalcificación de la zona como expresión de un foco inflamatorio óseo e hipervascularización, y finalmente con osteólisis franca. Finalmente se arriba en forma tardía al diagnóstico de Tuberculosis ósea a través de un cultivo positivo para Mycobacterium Tuberculosis del material obtenido quirúrgicamente de la zona, acompañado por una PPD hiperérgica y la presencia de granulomas en la anatomía patológica.
La evolución de la paciente a compromiso pulmonar y de SNC se interpretan como diseminación hematógena del foco óseo, probablemente condicionados por el uso de corticosteroides en varias oportunidades por el cuadro doloroso del pie.
La Tuberculosis secundaria en un paciente inmunocompetente es habitualmente un foco único, en este caso hubo afectación simultánea de pulmón y SNC por una probable diseminación hematógena masiva y sostenida que afectó el pulmón y el cerebro y meninges en forma difusa.
Llama la atención la ausencia de manifestaciones sistémicas como fiebre, sudoración nocturna, adelgazamiento sino hasta la parte final de la evolución, aunque no se descarta que puedan haber existido
Bibliografía
1) Extrapulmonary tuberculosis: an overview.
Golden MP, Vikram HR.
Am Fam Physician. 2005 Nov 1;72(9):1761-8
2) Extrapulmonary tuberculosis revisited: a review of experience at Boston City and other hospitals.
Alvarez S, McCabe WR.
Medicine (Baltimore). 1984 Jan;63(1):25-55
3) The diagnostic enigma of extra-pulmonary tuberculosis.
Sen P, Kapila R, Salaki J, Louria DB.
J Chronic Dis. 1977 Jun;30(6):331-50
4) Advisory Council for the Elimination of Tuberculosis, Advisory Committee on Immunization Practices. The role of BCG vaccine in the prevention and control of tuberculosis in the United States. A joint statement by the Advisory Council for the Elimination of Tuberculosis and the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep. Apr 26 1996;45(RR-4):1-18.
5) Chawla KP, Pandit AA, Jaiswal PK, Ahuja A. Osteoarticular tuberculosis with involvement of multiple sites (a case report). J Postgrad Med 1990;36:171
6) Berenguer J, Moreno S, Laguna F, et al. Tuberculous meningitis in patients infected with the human immunodeficiency virus. N Engl J Med. Mar 5 1992;326(10):668
7) Bhargava S, Gupta AK, Tandon PN. Tuberculous meningitis--a CT study. Br J Radiol. Mar 1982;55(651):189-96
8) Dastur DK, Manghani DK, Udani PM. Pathology and pathogenetic mechanisms in neurotuberculosis. Radiol Clin North Am. Jul 1995;33(4):733-52.
9) Rich AR, McCordick HA. The pathogenesis of tuberculous meningitis. Bulletin of John Hopkins Hospital. 1933;52:5-37
10) Seth R, Sharma U. Diagnostic criteria for Tuberculous Meningitis. Indian J Pediatr. Apr 2002;69(4):299-303
En breve se publicarán las imágenes del caso en cuestión. Mientras tanto en la columna de la izquierda de la página se pueden observar algunas imágenes relacionadas con el caso
Presentó la Dra Silvina Mondini
martes, 10 de junio de 2008
Ateneo Hospital Pintos 11/06/2008. Mujer de 40 años con anemia e hipergamaglobulinemia

Se presenta el caso de una paciente mujer de 40 años que acude a la consulta en noviembre de 2003, para control general, refiriendo como única sintomatología astenia.
Como antecedente presenta anemia microcítica e hipocrómica de larga data (1994) y valores elevados de eritrosedimentación (mayores a 100).
En ese momento (1994) se realizó una punción de médula ósea que informó: serie eritroblástica discretamente aumentada। Secuencia conservada con discretos cambios megaloblásticos. Aislados elementos con puentes intercitoplasmaticos. Serie granulocítica conservada a predominio de series maduras; algunos elementos con tendencia al gigantismo celular. Relación mieloide-eritroide 1.2/1. Megacariocitos conservados. Células reticulares conservadas de aspecto normal. Células plasmáticas discretamente elevadas de aspecto maduro. Hemosiderina en medula ósea (Reacción de Perls) negativa. No se observan células atípicas. CONCLUSION: discreta hiperplasia de la serie eritroide, depósitos férricos ausentes y plasmocitosis de aspecto reaccional. Discretos signos de dispoyesis.
En 1995 fue internada por cuadro de pericarditis aguda. Se realizó laboratorio general, constatándose anemia, eritrosedimentación elevada, con FAN, látex y complemento normales. El ecocardiograma demostró derrame pericárdico leve. Evolucionó favorablemente y fue dada de alta en tratamiento con aspirina y sulfato ferroso.
Al momento de la consulta (2003), el examen físico revela palidez mucocutánea,signos vitales estables,índice de masa corporal normal,resto sin particularidades.
Se realiza nueva evaluación hematológica (noviembre de 2003) que demuestra anemia, hipergammaglobulinemia policlonal y eritosedimentación elevada (ver tabla).
Se investigan también cadenas Kappa y Lambda en orina, no detectándose cadenas livianas, con una relación Kappa/ Lambda en suero conservada.
Un nuevo ecocardiograma de control, (diciembre 2003) informa mínimo derrame pericárdico posterior.
Se realiza entonces, una nueva punción biopsia de médula ósea (junio 2004) que informa: Tejido óseo de sostén con edema y extravasación hemática multifocal (20% vol), sinusoides dilatados. Depósitos de hemosiderina muy disminuidos. Tejido adiposo 35%. Tejido hematopoyético 45% del volumen total. Relación mieloeritroide disminuida por hiperplasia de la serie roja. Serie roja: grandes nidos con células semimaduras y maduras, cambios megaloblasticos extensos. Serie mieloide: células semimaduras, metamielocitos gigantes y predominio de polimorfonucleares. Megacariocitos escasos en numero, y se reconocen células de distinto tamaño, algunas polinucleadas y otras mononucleadas. También se observa aumento del número de plasmocitos, predominantemente perivasculares y maduros. CONCLUSION: hiperplasia moderada de la serie eritroide, megaloblástica y discreta disminución del número de megacariocitos, con alteraciones dismórficas. Plasmocitosis reactiva (mayor a 10 % del tejido hematopoyético) acompañado de infiltrado linfohistioide intersticial.
La radiografía de cráneo (noviembre 2004) fue de características normales.
Para completar el estudio de anemia, se procede al estudio del sistema digestivo mediante una esofagogastroduodenoendoscopia (diciembre 2004), que informa: cuerpo gástrico con múltiples lesiones erosivas, algunas con evidencias de sangrado antiguo. Antritis máculo-papulosa activa, sin lesión deprimida. Bulbo duodenal sin lesiones.
La biopsia del tracto superior diagnostica difusa antritis crónica con actividad de grado moderado, no asociado a cambio metaplásico intestinal y se reconoce la presencia de Helicobacter Pylori .
También se realiza una colonovideoendoscopía sin organicidad ni lesiones tumorales.
Cabe destacar que la paciente presenta ciclos menstruales regulares sin hipermenorrea.
Luego del tratamiento específico para erradicar H. Pylori, se realiza una segunda endoscopía y biopsia (2005) que informa: gastropatía antral reactiva (química) no asociada a H. Pylori con edema focal y congestión capilar. No se reconoce H. Pylori con la coloración realizada.
A pesar de los tratamientos con hierro, en controles posteriores persiste con astenia y los controles de laboratorio sin mejoría: la anemia, eritrosedimentación elevada e hipergammaglobulinemia eran las constantes.
Por último, se solicita ecografía abdominal (2006) que informa el hallazgo de una formación nodular sólida de 65 mm en sentido axial por 51 mm en sentido longitudinal, ubicada por detrás del lóbulo derecho hepático, adyacente a la vesícula biliar y por delante del riñón derecho. Resto normal.
Ecografía ginecológica: Útero en AVF de tamaño normal. Endometrio de 7 mm.
TAC de abdomen y pelvis (2006): Formación expansiva sólida de 6 cm de diámetro con pequeñas calcificaciones en sus paredes y que refuerza con contraste, ubicada por debajo del lóbulo hepático derecho y la vesícula biliar. Tiene contacto con la fascia de Gerota y la cara anterior del riñon derecho por su parte posterior y con la fascia transversalis en su parte anterior. La lesión aparenta ser independiente. Se observa pequeña cantidad de líquido libre en fondo de saco de Douglas. Imagen quística en anexo derecho. Resto sin alteraciones.
RMN de abdomen (2006): Sobre la zona del flanco derecho, en la región subhepática entre el lóbulo derecho del hígado y el riñon derecho se observa una MOE de contornos netos, perfectamente definidos que mide aproximadamente 64 mm de diámetro anteroposterior y 52 mm de diámetro vertical. Isointenso a la masa muscular en T1. Tenuemente hiperintenso y heterogéneo en T2. Presenta un intenso realce post-inyección de gadolinio endovenoso. Provoca compresión extrínseco de las estructuras vecinas sin invadirlas. No se observan adenomegalias retroperitoneales ni ascitis.
Se realiza procedimiento diagnóstico.
Tabla: Laboratorio (2003) Glóbulos rojos 3।700.000 x mm3 Hemoglobina 8.20 grs. % Hematocrito 29%
Valor globular 0।74 V।C.M 78.37 fl Leucocitos 4।200 x mm 3 . Neutrófilos en cayado 0 %। Neutrófilos seg 78 %
Eosinófilos 0 % Basófilos 2 Linfocitos 17 % Monocitos 3 % Plaquetas 220।000
Bilirrubina T 4.20mg/l (D 1.10mg/l - Ind 3.10mg/l) Enzimas hepáticas normales. Función renal: normal.
Orina completa: normal। Reticulocitos 2 % Sideremia 64 ug/ dl TIBC 234 ug % । Porcentaje de saturación 27.30 %
Ferritina 67।5 ng/ml (VN: 9-120 ng/ml) VES: 140 mm /h। PCR 12 mg/l Dosaje de Ig A 418 mg/ dl ( 110- 195) Ig G 2859 mg/dl (850- 1450) Ig M 323 mg/dl (100-200) Complemento C3: 175 mg/d Complemento C4: 26 mg/dl CH 50: 30 u.h. 50% FAN: negativo AntiADN: negativo Latex: 10 UI/ml. HIV negativo
Año 2006 CA 125 4।78 U/ml (VN menor de 35U/ml) CEA 0।98 U/ml (VN hasta 4.6 U/ml)
El procedimiento diagnóstico fue una biopsia incisional por punción y el diagnóstico definitivo de la misma fue :
Enfermedad de Castleman (no consta la variedad histológica)
Después de obtener el resultado , se completó la estadificación del cuadro y se procedió a la escisión quirúrgica completa de la masa tumoral la cual pudo realizarse técnicamente sin inconvenientes.
La evolución de la paciente fue excelente con mejoría de su cuadro de astenia, la desaparición de la anemia, la hipergamaglobulinemia y la eritrosedimentación acelerada.
La remisión clínico humoral se mantiene varios años después del tratamiento
Enfermedad de Castleman
Es una enfermedad de los ganglios linfáticos y tejidos relacionados, descripta primeramente por Benjamín Castleman en Boston en 1956.
Aunque no se la considera una enfermedad cancerosa , la forma multicéntrica de la enfermedad se parece mucho a un linfoma. Además muchos pacientes evolucionan a linfomas. Se caracteriza por crecimiento de células no cancerosas que desarrollan en los ganglios linfáticos en un sitio único o en forma diseminada. Las células comprometidas pertenecen al linaje B y a menudo producen secreción de citoquinas sobre todo IL6 que es la responsable de muchos, o de casi todos los síntomas cuando los hay ( fiebre, sudoración, pérdida de peso), así como las manifestaciones de laboratorio (anemia, VSG acelerada etc). Hay varias formas clínicas e histopatológicas de Enfermedad de Castleman (EC). Desde el punto de vista clínico hay dos formas : la forma localizada y la forma multicéntrica , y desde el punto de vista histológico también hay dos formas: la Hialino vascular y la Plasmocitaria.
En su patogenia se ha implicado en forma relativamente reciente al Herpes virus Humano tipo 8 (HHV8) (sobre todo en la forma multicéntrica de la enfermedad) que es a su vez causante de Sarcoma de Kaposi. En este caso, de que la enfemedad sea multicéntrica y esté asociada a la infección del HHV8, la IL6 sería codificada por un gen viral ( v IL6)
Usualmente, el paciente con tipo vascular hialino es asintomático y tiene una evolución en general benigna, pero el de tipo plasmocelular frecuentemente se asocia con síntomas sistémicos que ameritan resección quirúrgica, seguimiento estrecho e incluso hasta quimioterapia.En una serie importante de casos la mayoría de los pacientes eran niños o adultos jóvenes cuya manifestación clínica principal era la presencia de una masa abdominal o mediastínica con algunas anormalidades de laboratorio, tales como anemia, hipoalbuminemia, eritrosedimentación elevada e hiperglobulinemia policlonal. Sin embargo, se han dado reportes que manifiestan características clínicas poco usuales, como por ejemplo, una variante mixta o transicional de la enfermedad de Castleman asociada con derrames pleurales quilosos bilaterales. En otra serie se reporta que las adenopatías generalmente se encuentran localizadas en el tórax (60%), cuello (14%), abdomen (11%) y axilas (4%). Sin embargo ocasionalmente se han reportado localizaciones atípicas, tales como una lesión única intracraneal descrita por Hashimoto. En algunas oportunidades la EC ha sido reportada en asociación con otras patologías, entre ellas sarcoma de Kaposi , glomerulonefritis y lupus eritematoso sistémico. También se ha asociado con condiciones más atípicas tales como fenómenos trombóticos asociaciado con una trombosis de la vena cava superior, y las asociaciones con síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, proteinemia monoclonal y cambios cutáneos). Lo anterior demuestra que la EC es una condición clínica que representa un reto para el diagnóstico clínico, ya que además de la presentación de las adenopatías, puede tener asociaciones con múltiples condiciones que pueden hacer difícil establecer el diagnóstico.
Etiología y etiopatogenia
La causa real de la EC es desconocida hasta la fecha y la evidencia actual es escasa y especulativa, pero se han demostrado que pudiera existir alguna relación entre el virus humano herpes 8 (HHV8) al documentar que 3 pacientes con EC tipo multicéntrica mostraron anticuerpos séricos elevados para HHV8. Recientemente se ha encontrado secuencias de DNA del HHV8 en los ganglios linfáticos de pacientes con EC multicéntrica y los datos actuales sugieren que la sobreproducción de IL-6 por lo nódulos linfáticos hiperplásicos juegan un papel determinante en el desarrollo de las formas clínicas de la EC. En el caso de EC asociada a infección por HHV8 y SK el genoma viral codificaría la IL6 en cuyo caso esta se llama (vIL6). Este virus es llamado también herpes virus asociado a sarcoma de Kaposi (KSHV) debido a que ha sido encontrado en muestras de tejido de sarcoma de Kaposi de pacientes con sida. La IL-6 es una proteína multifuncional que está involucrada en procesos de proliferación, diferenciación y maduración. Su principal papel es estimular a los hepatocitos para producir proteínas de fase aguda, pero además es un factor de crecimiento y diferenciación de los linfocitos B para que se transformen en células plasmáticas. El estado de proliferación persistente de linfocitos y/o de células plasmáticas resultante propiciaría el desarrollo de linfomas malignos. Otro efecto de la IL-6 resulta en la continua estimulación de las células endoteliales, por la liberación de factores de crecimiento angiogénicos o vasculares, que podría llevar a la formación de neoplasias de origen vascular, además, la IL-6 tiene efectos moduladores sobre la función inmune y la hematopoyesis, y muchas de las manifestaciones sistémicas observadas en la EC como debilidad, fiebre, presencia de reactantes de fase aguda e hipergammaglobulinemia, podrían explicarse por la elevación de los niveles séricos de IL-6. Asismismo, los niveles elevados de IL-6 parecieran ser los responsables de la patogénesis de las manifestaciones renales que han sido descritas, así como de producir un efecto inhibitorio en la diferenciación eritroide reflejado por una eritropoyesis hipoproliferativa y anemia microcítica. Además de la EC, la IL-6 ha sido implicada en la patología del mieloma múltiple, la artritis reumatoide y la osteoporosis post-menopáusica y la psoriasis.
Otras de las causas patogénicas implicadas incluyen inflamación crónica de baja intensidad, procesos hamartomatosos, estados de inmunodeficiencia y autoinmunidad, además de infecciones con virus de Ebstein-Barr, toxoplasmosis y Mycobacterium tuberculosis.
Manifestaciones clínicas
Las manifestaciones clínicas de la Enfermedad de Castleman (EC)dependen fundamentalmente de la variedad histológica. Usualmente la variedad vascular hialina se presentó como una adenopatía única sin manifestaciones sistémicas y la variante plasmocelular se asocia con múltiples manifestaciones clínicas y de laboratorio. Muchas manifestaciones clínicas se han asociado con la EC.
Variedad vascular hialina
La gran mayoría de las veces la variedad vascular hialina (VVH) es la de un tumor asintomático y localizado que se descubre en forma accidental. Afecta principalmente a adultos jóvenes del sexo femenino. La localización tumoral más frecuente es mediastinal, seguida del cuello y abdominal; aunque ha sido descrita en muchos sitios, como en la pared torácico, mediastino, retroperitoneo, músculo-esquelético, axilas, parénquima pulmonar, pelvis, región inguinal y supraclavicular, mesenterio y hasta en el cerebro con tamaños tan diversos que oscilan entre 2.5 hasta 12cm. Esta variante casi nunca recurre después de la resección quirúrgica. Ocasionalmente presenta sintomatología asociada. En una serie importante, la VVH de asoció a síntomas tan diversos como lumbalgia, ardor axilar, dolor torácico artralgias, mialgias, parestesias de las manos y pies, tos productiva, disnea, dedos hipocráticos, elevación de las pruebas de función hepática y eritrosedimentación aumentada, trombocitopenia, anemia, leucopenia, hipoalbuminemia y elevación de los niveles séricos de IL-6.
Variedad plasmocelular
Ocurre principalmente en 2 formas: localizada y multicéntrica. La primera afecta un solo sitio anatómico. Puede afectar a sujetos de cualquier edad, pero más frecuentemente a los adultos jóvenes. Los síntomas sistémicos son frecuentes e incluyen pérdida de peso y fatiga, alteraciones de laboratorio tales como anemia, eritrosedimentación elevada e hipergamaglobulinemia. Después de la escisión quirúrgica los síntomas usualmente desaparecen.
La forma multicéntrica es histológicamente similar a la forma localizada, es una enfermedad sistémica con linfadenopatías generalizadas. Tiene un curso clínico agresivo y fatal asociado con complicaciones infecciosas y con riesgo de desarrollar tumores malignos, tales como linfoma o sarcoma de Kaposi. Usualmente evoluciona en uno de 4 cursos: recaídas y remisiones, estable y persistente, rápidamente fatal y/o transformación a linfoma maligno. Muchos enfermos asocian hepatoesplenomegalia, síntomas neurológicos y enfermedad renal. La mayoría de los pacientes con enfermedad del tipo plasmocelular son adultos jóvenes.
En una serie, la edad promedio fue de 35 años (rango de 26-72), con mayor frecuencia en el sexo femenino. Los pacientes presentaron; fatiga (100%), fiebre (31%), pérdida de peso (62%) y sudoración nocturna (62%). Las adenopatías fueron periféricas (100%), abdominales (62%) y mediastínicas (25%). También presentaban esplenomegalia (50%), hepatomegalia (25%) y se asociaron en un 12% a linfoma no Hodgkin .
La enfermedad multicéntrica puede ameritar quimioterapia o radioterapia para los casos en los que no se puede resecar la lesión. A pesar de tratamientos agresivos, la sobrevida media para la enfermedad multicéntrica es de aproximadamente 26 meses, comparado con casi un 100% de sobrevida a los 5 años para la forma localizada vascular hialina de la enfermedad de Castleman. La variante multicéntrica plasmocelular se asocia más tipicamente con sarcoma de Kaposi y se ha descrito en pacientes con HIV puede asociarse tardíamente con neoplasias vasculares, las que pueden desarrollarse incluso hasta 8 años después del diagnóstico inicial de la enfermedad, por lo que es necesario un seguimiento de los pacientes a largo plazo.
Tratamiento:
En la forma localizada la resección quirúrgica es generalmente curativa y el pronóstico es excelente. La forma multicéntrica tiene peor pronóstico con una expectativa de vida de 2 años, pudiendo evolucionar a Anemia Hemolítica Autoinmune o Linfoma no Hodgkin. En los pacientes HIV positivos y evidencias de infección por Herpes Virus Humano Tipo 8 y Sarcoma de Kaposi el tratamiento con Aciclovir y Rituximab (anti CD 20) puede mejorar el pronóstico. Se han hecho ensayos con Tocilizumab, un anticuerpo monoclonal humanizado anti IL6 que mostró revertir las manifestaciones clínicas y de laboratorio de la Enfermedad de Castleman
Conclusiones: se presentó una paciente con antecedentes de Anemia microcítica hipocrómica y VSG acelerada de varios años de evolución con relativo buen estado general y con la única sintomatología de astenia. La anemia y VSG de > 100 mm acelerada se remontaban a nueve años atrás.
El síndrome anémico fue caracterizado como anemia por déficit de hierro debido a que la paciente presentaba en la coloración de Perls con ferrocianuro de potasio en MO la ausencia de hierro en forma de Hemosiderina, lo cual es un dato que confirma la ferropenia, mas allá de que el frotis de sangre periférica eran muy sugestivas de esa condición, así como los índices hematimétricos(VCM 78,37 fl ). La presencia de una ferremia normal, saturación de Transferrina de 27% y una Ferritina de 67,5 ng/ml, esta última probablemente como reactante de fase aguda, no descartan la ausencia de hierro.
El porcentaje de reticulocitos de 2% para su grado de anemia de 3.700.000 GR/mm3 da un valor absoluto de 74.000 reticulocitos /mm3, lo que la clasifica como anemia hiporegenerativa
Es interesante la presencia de Bilirrubina alta a expensas de la B Indirecta, ya que la misma puede darse en una situación de hemólisis o en un Síndrome de Gilbert. Lamentablemente no constan en la historia clínica otros elementos indicativos de hemólisis como LDH y Haptoglobina sérica. La ausencia de reticulocitosis aboga contra un fenómeno hemolítico aunque si este está asociado a déficit severo de hierro podría darse hipotéticamente la asociación de hemólisis con reticulocitopenia.
En el laboratorio llamó la atención la presencia de una hipergamaglobulinemia policlonal muy significativa de 3,6 grs de gammaglobulina/100 ml a expensas de IgG, IgM, e IgA. Las hipergamaglobulinemias pueden ser a expensas de un tipo de inmunoglobulina (monoclonal) o de varias de ellas (policlonal). Cuando son monoclonales, además de verse un aumento “angosto” en la corrida electroforetica, hay generalmente una disminución del resto de las inmunoglobulinas, motivo por el cual el Mieloma Múltiple o la Macroglobulinemia de Waldenstrom por ejemplo, cursan con inmunodepresión.
En el caso de nuestra paciente, presentaba una hipergamaglobulinemia a expensas de todas las inmunoglobulinas, porque aunque no consta en la historia clínica la imagen del proteinograma electroforético, se puede observar la cuantificación de por lo menos 3 de ellas (IgG, IgA, e IgM), por inmunodifusión radial cuantitativa. El significado de esta hipergamaglobulinemia en nuestra paciente es de carácter inespecífico, y en la Enfermedad de Castleman se debe a la Hipersecreción de IL6, y tiene como sustrato el aumento del porcentaje de células plasmáticas observado en la PAMO (>10%).
La Interleukina 6 es una glucoproteína segregada por los macrófagos , las células T, las células endoteliales y los fibroblastos. Su liberación es inducida por IL1 y se incrementa en respuesta a TNF alfa. La IL6 es una citoquina tanto proinflamatoria como antiinflamatoria, y se segrega en respuesta al trauma, quemaduras, y cualquier tipo de inflamación. También es una miokima, o sea una citoquina secretada por el músculo, y se eleva en la contracción muscular. Está aumentada en respuesta al ejercicio muscular movilizando sustratos extracelulares. Adicionalmente los Osteoblastos secretan IL6 para estimular la formación de Osteoclastos. Las células musculares lisas en la túnica media de muchos vasos sanguíneos también producen IL6 como citoquina proinflamatoria.
La IL6 es uno de los mas importantes mediadores de la fiebre y de la respuesta de fase aguda. En el músculo y el tejido graso la IL6 estimula la movilización de energía. La IL-6 es una proteína multifuncional que está involucrada en procesos de proliferación, diferenciación y maduración. Su principal papel es estimular a los hepatocitos para producir proteínas de fase aguda, pero además es un factor de crecimiento y diferenciación de los linfocitos B para que se transformen en células plasmáticas. El estado de proliferación persistente de linfocitos y/o de células plasmáticas resultante propiciaría el desarrollo de linfomas malignos. Otro efecto de la IL-6 resulta en la continua estimulación de las células endoteliales, por la liberación de factores de crecimiento angiogénicos o vasculares, que podría llevar a la formación de neoplasias de origen vascular, además, la IL-6 tiene efectos moduladores sobre la función inmune y la hematopoyesis, y muchas de las manifestaciones sistémicas observadas en la EC como debilidad, fiebre, presencia de reactantes de fase aguda e hipergammaglobulinemia, podrían explicarse por la elevación de los niveles séricos de IL-6. Asismismo, los niveles elevados de IL-6 parecieran ser los responsables de la patogénesis de las manifestaciones renales que han sido descritas, así como de producir un efecto inhibitorio en la diferenciación eritroide reflejado por una eritropoyesis hipoproliferativa y anemia microcítica
Se podría decir para concluir, que la Enfermedad de Castleman es un modelo de enfermedad producida por una citoquina, ya que ésta, la IL6 está implicada en la patogénesis de la enfermedad desde sus estadios mas tempranos produciendo señales de proliferación, síntesis, maduración y diferenciación que a veces culminan con la transformación neoplásica. Quizá sea un modelo simple para comprender la patogenia de casi todas las enfermedades, simple en el sentido de la presencia de una sola citoquina, a diferencia de la mayoría de otras entidades donde la combinación de varias de ellas en forma sucesiva , secuencial o simultánea le van dando el perfil específico
En el caso de nuestra paciente, lamentablemente no consta en la historia clínica la variedad histológica, aunque si sabemos que era una forma localizada de la enfermedad y que se comportó como tal después del tratamiento quirúrgico con remisión de todos sus síntomas, signos y manifestaciones de laboratorio
Bibliografía
Anti-interleukin-6 receptor antibody treatment in inflammatory autoimmune diseases.
Rev Recent Clin Trials. 2006 Sep;1(3):193-200. Review.
PMID: 18473972 [PubMed - indexed for MEDLINE]
Ding C, Jones G.
Multicentric Castleman's disease in two cases.
Indian J Pediatr. 2007 Dec;74(12):1116-20. Review.
PMID: 18174650 [PubMed - indexed for MEDLINE
Sharma R, Seth R, Thavaraj V, Bagga A, Kabra SK, Karak AK, Atri S
Kaposi sarcoma-associated herpesvirus/human herpesvirus 8 and lymphoproliferative disorders.
J Clin Pathol. 2007 Dec;60(12):1350-7. Review.
PMID: 18042691 [PubMed - indexed for MEDLINE]
Du MQ, Bacon CM, Isaacson PG.
[Two HHV8-related illnesses in a HIV-negative patient: Kaposi's sarcoma and multicentric Castleman's disease. Response to treatment with Rituximab and CHOP]
Actas Dermosifiliogr. 2006 Jul-Aug;97(6):385-90. Review. Spanish.
PMID: 16956518 [PubMed
Pastor MA, Vasco B, Mosquera JM, Debén G, Bautista P, Requena L.
Fifty years of multicentric Castleman's disease.
Acta Oncol. 2004;43(8):698-704. Review.
PMID: 15764213 [PubMed - indexed for MEDLINE]
Waterston A, Bower M.
Update on Kaposi's sarcoma and other HHV8 associated diseases. Part 2: pathogenesis, Castleman's disease, and pleural effusion lymphoma.
Lancet Infect Dis. 2002 Jun;2(6):344-52. Review.
PMID: 12144897 [PubMed - indexed for MEDLINE]
Hengge UR, Ruzicka T, Tyring SK, Stuschke M, Roggendorf M, Schwartz RA, Seeber S.
[Castleman's disease in patients infected with HIV]
Rev Med Interne. 2002 Feb;23(2):155-63. Review. French.
PMID: 11876059 [PubMed - indexed for
Aaron L, Lidove O, Viard JP, Troisvallet D, Piketty C, Vittecoq D, Zucman D, Blétry O, Dupont B.
KSHV/HHV8-associated lymphoproliferations in the AIDS setting.
Eur J Cancer. 2001 Jul;37(10):1217-26. Review.
PMID: 11423254 [PubMed - indexed for MEDLINE]
Schulz TF.
Castleman's disease and related disorders.
Semin Diagn Pathol. 1988 Nov;5(4):346-64. Review.
PMID: 2464187 [PubMed - indexed for MEDLINE
Frizzera G.
Castleman disease.
Curr Opin Hematol. 2007 Jul;14(4):354-9. Review.
PMID: 17534161 [PubMed - indexed
Dham A, Peterson BA
Interleukin 6: from bench to bedside.
Nat Clin Pract Rheumatol. 2006 Nov;2(11):619-26. Review. Erratum in: Nat Clin Pract Rheumatol. 2006 Dec;2(12):691.
PMID: 17075601 [PubMed - indexed for MEDLINE
Nishimoto N, Kishimoto T.
[Anti-interleukin-6 receptor antibody therapy--from bedside to bench]
Nihon Rinsho Meneki Gakkai Kaishi. 2006 Oct;29(5):289-94. Review. Japanese.
PMID: 17075187 [PubMed - indexed for
Nishimoto N.
Human herpesvirus-8: beyond Kaposi's .
Isr Med Assoc J. 2006 Jul;8(7):489-93. Review.
PMID: 16889165 [PubMed - indexed for MEDLINE
Rimar D, Rimar Y, Keynan Y.
."Cytokines and the brain corticosteroid receptor balance: relevance to pathophysiology of neuroendocrine-immune communication.". Psychoneuroendocrinology 19 (2): 121-34.
De Kloet ER, Oitzl MS, Schöbitz B (1994).
FIEDLER-VELASQUEZ, Eduardo, GOURZONG- TAYLOR, Charles, GOYENAGA-HERNANDEZ, Pedro et al. Enfermedad de Castleman. Reporte de 14 casos de 1990-2002 en el "Hospital Dr. Rafael Angel Calderón Guardia", dos con presentación inusual y revisión de literatura. Acta méd. costarric. [online]. jul. 2005, vol.47, no.3
Suscribirse a:
Entradas (Atom)
