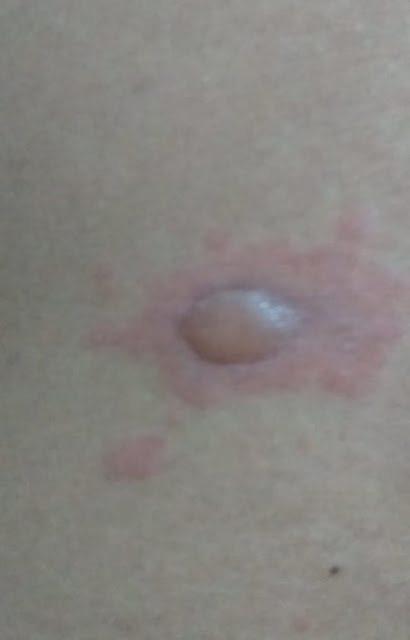
Paciente de 29 años, sin antecedentes de importancia, con aparición de lesiones vesiculares sobre fondo eritematoso desde hace un año, a predominio de miembros superiores, inferiores y torax, no dolorosas y muy pruriginosas; que desaparecen esporádicamente dejando áreas de piel hiperpigmentadas. Se asocian dolor tipo cólico eventual, en región epigástrica asociado a constipación esporádica. No deposiciones reducidas de consistencia ni baja de peso. Niega consumo de medicamentos fuera de prescripción médica.
El cuadro clínico, el resultado de la histopatología
así como la inmunofluorescencia así como la respuesta terapéutica a la
supresión del gluten confirman el diagnóstico de dermatitis herpetiforme.
Genileza
Dr. Luis Eduardo Cervera Caballero.
Lima Perú.
DERMATITIS HERPETIFORME
INTRODUCCIÓN
La dermatitis herpetiforme (DH) es una erupción
cutánea autoinmune poco común que es una manifestación de sensibilidad al
gluten. Los pacientes afectados suelen desarrollar pápulas y vesículas
inflamatorias intensamente pruriginosas en los antebrazos, las rodillas, el
cuero cabelludo o las nalgas (imagen 1,2,3,4,5,6). La gran mayoría de los
pacientes con DH también tienen asociada una enteropatía sensible al gluten
(enfermedad celíaca). En la mayoría de estos pacientes, la enteropatía es
mínimamente sintomática o asintomática.
La DH suele responder bien al tratamiento. La
dapsona y una dieta sin gluten son las principales intervenciones para el
tratamiento de esta enfermedad.
Imagen 1: dermatitis herpetiforme
Hay pápulas y vesículas eritematosas en la rodilla.
Imagen 2: dermatitis herpetiforme.
En las rodillas hay múltiples pápulas y vesículas eritematosas.
Imagen 3: dermatitis herpetiforme.
Algunas vesículas presentes cerca del codo.
Imagen 4: dermatitis herpetiforme.
Hay múltiples pápulas y vesículas inflamatorias
cercanas al codo.
Imagen 5: dermatitis herpetiforme.
Vesículas, ampollas, erosiones y costras en la piel
del codo.
Imagen 6: dermatitis herpetiforme.
Cerca del codo hay múltiples pápulas excoriadas y
costras.
EPIDEMIOLOGÍA
La DH es un trastorno poco común que ocurre con
mayor frecuencia en personas de ascendencia europea del norte. Los estudios
epidemiológicos del norte de Europa han encontrado tasas de incidencia entre
0,4 y 3,5 por 100.000 personas por año y tasas de prevalencia entre 1,2 y 75,3
por 100.000 personas [ 1-8 ]. Un estudio poblacional en Utah, un lugar con una
proporción relativamente alta de individuos con ascendencia del norte de
Europa, encontró tasas de incidencia y prevalencia similares a las reportadas
en Europa [ 9 ]. Entre 1978 y 1987, la incidencia de DH fue de 0,98 por 100.000
personas por año, y la prevalencia de DH en 1987 fue de 11,2 por 100.000
personas.
La incidencia de DH puede estar disminuyendo. Un
análisis de datos de pacientes del Clinical Practice Research Datalink en el
Reino Unido encontró una disminución en la incidencia de 1,82 por 100.000
personas-año en 1990 a 0,8 por 100.000 personas-año en 2011 [ 10 ]. Un estudio
finlandés que comparó la incidencia de DH diagnosticada dentro de un distrito
hospitalario universitario en tres décadas sucesivas, a partir de 1970, también
encontró tasas decrecientes de DH [ 3 ]. La incidencia anual estimada para cada
década fue de 5,2, 2,9 y 2,7 por 100.000 personas, respectivamente. No se ha
confirmado la razón de la disminución observada en la incidencia de DH. Una
mayor detección y tratamiento de la enfermedad celíaca leve es un contribuyente
potencial.
Los estudios epidemiológicos han encontrado que los
hombres tienen más probabilidades de desarrollar DH que las mujeres; las
proporciones informadas entre hombres y mujeres han oscilado entre 1,1: 1 y
1,9: 1 [ 3 ]. Se desconoce el motivo del predominio masculino en DH.
Aunque a menudo se informa que la edad media de
aparición de la enfermedad es en la cuarta o quinta década [ 3 ], las personas
de todas las edades pueden verse afectadas [ 3,11 ]. La DH es poco común en los
niños. En el estudio finlandés mencionado anteriormente, solo 18 de 477
pacientes con DH eran niños (4 por ciento) [ 3 ].
PATOGÉNESIS
La patogenia de la DH parece ser compleja e implica
tanto factores intrínsecos como extrínsecos. Al igual que la enfermedad celíaca,
la DH se considera una manifestación de sensibilidad al gluten que es más
probable que ocurra en individuos genéticamente susceptibles. La importancia
del gluten en la patogenia de estos trastornos se sustenta en la observación de
que la eliminación del gluten en la dieta da como resultado la remisión de
ambas enfermedades.
El examen histológico de las muestras de biopsia de
piel respalda un papel importante para el sistema inmunológico en la DH. El
depósito subepidérmico de inmunoglobulina A (IgA) y los infiltrados dérmicos
neutrofílicos en la dermis superficial son hallazgos característicos de esta
enfermedad.
Predisposición genética: ciertos genes del antígeno leucocitario
humano (HLA) predisponen al desarrollo de DH. Prácticamente todos los pacientes
con DH son portadores del haplotipo HLA DQ2 o HLA DQ8 [ 12 ]. Este concepto fue
evidente en un estudio comparativo de 50 sujetos con DH y 290 controles sanos [
13 ]. El estudio encontró que los genes que codifican HLA DQ2 eran portados por
el 86 por ciento de los pacientes con DH, en comparación con solo el 25 por ciento
de los controles sanos. Además, seis de los siete pacientes con DH que
resultaron negativos para HLA DQ2 fueron positivos para HLA DQ8. La importancia
de HLA DQ2 y HLA DQ8 probablemente esté relacionada con su papel en la
promoción de una respuesta inmune contra los péptidos de gliadina. Los factores
genéticos no HLA también pueden influir en el riesgo de desarrollar DH [ 14 ].
Una contribución genética a la DH está respaldada
por estudios familiares que demuestran que los familiares de primer grado de
pacientes con DH tienen un mayor riesgo de DH y enfermedad celíaca [ 15-17 ].
En una cohorte finlandesa de más de 1000 pacientes con DH, el 4% informó que
tenía un familiar de primer grado con DH y el 6% informó que tenía un familiar
de primer grado con enfermedad celíaca [ 17 ].
Sensibilidad al gluten: el fuerte vínculo epidemiológico entre la DH
y la enfermedad celíaca respalda firmemente una patogénesis compartida que
involucra la sensibilidad al gluten. Más del 90 por ciento de los pacientes con
DH presentan hallazgos de biopsia del intestino delgado compatibles con algún
grado de enteropatía sensible al gluten.
Tanto el sistema inmunológico adaptativo como el
innato pueden contribuir al desarrollo de las manifestaciones clínicas de la
sensibilidad al gluten. Los péptidos de gliadina (péptidos derivados de la
digestión del gluten) y la transglutaminasa tisular (una enzima dependiente del
calcio que cataliza los enlaces cruzados entre los residuos de proteínas de
glutamina y lisina y forma enlaces covalentes con la gliadina) son antígenos
clave [ 18 ]. Los anticuerpos contra la transglutaminasa tisular están
presentes en el suero de los pacientes afectados y se utilizan para respaldar
el diagnóstico de DH y enfermedad celíaca.
Una vía potencial a través de la cual la exposición
al gluten de la dieta podría conducir a DH es la siguiente [ 19-22 ]:
- Después de la ingestión y digestión de alimentos que contienen gluten, la gliadina se absorbe en la mucosa intestinal.
- La gliadina es desaminada por la transglutaminasa tisular en la mucosa intestinal y se forman enlaces cruzados covalentes entre la gliadina y la transglutaminasa tisular.
- Los péptidos de gliadina desaminada se unen a las moléculas HLA DQ2 o HLA DQ8 en las células presentadoras de antígenos, donde son reconocidos por las células T colaboradoras.
- Las células T activadas luego producen citocinas proinflamatorias y metaloproteinasas de matriz que estimulan el daño a la mucosa intestinal y la producción de anticuerpos contra la transglutaminasa tisular por parte de las células B.
- Con el tiempo, la diseminación de epítopes (el desarrollo de una respuesta inmune contra un antígeno endógeno o múltiples antígenos endógenos debido a la exposición de un antígeno endógeno durante el daño tisular) puede ocurrir y contribuir a la producción de anticuerpos que son capaces de unirse a la transglutaminasa epidérmica.
- Los anticuerpos antiepidérmicos transglutaminasa IgA viajan a través del torrente sanguíneo y, al llegar a la piel, forman un complejo con la transglutaminasa epidérmica en la dermis.
- El depósito de inmunocomplejos en la dermis estimula la quimiotaxis de los neutrófilos y la escisión proteolítica dentro de la lámina lúcida, lo que provoca la formación de ampollas.
HALLAZGOS CLINICOS
Los pacientes con DH pueden experimentar
manifestaciones cutáneas, orales y gastrointestinales relacionadas con la
sensibilidad al gluten.
Manifestaciones cutáneas: el hallazgo clínico clásico en la DH es el
desarrollo de múltiples pápulas y vesículas intensamente pruriginosas que se
presentan en arreglos agrupados ("herpetiformes"). Los codos,
antebrazos dorsales, rodillas, cuero cabelludo, espalda y glúteos se encuentran
entre los sitios más comunes para el desarrollo de lesiones (imagen 1 a 6). La
cara y la ingle son lugares de afectación menos frecuentes [ 24 ].
Debido al prurito asociado, generalmente se observan
muy pocas pápulas o vesículas intactas en la exploración clínica. Las erosiones
y excoriaciones tienden a ser los hallazgos clínicos más abundantes.
El grado de afectación cutánea varía mucho. Los
pacientes con enfermedad leve presentan afectación limitada a unas pocas áreas
localizadas, como las rodillas o los antebrazos dorsales, mientras que los
pacientes con enfermedad grave presentan lesiones ampliamente distribuidas en
el tronco y las extremidades. Las lesiones cutáneas suelen curar sin dejar
cicatrices. Sin embargo, pueden desarrollarse cambios pigmentarios posinflamatorios
[ 18 ].
Las petequias o máculas purpúricas en los dedos o
las palmas son características clínicas poco frecuentes de la DH. Es más
probable que estas lesiones se produzcan en niños, pero también pueden aparecer
en adultos [ 25-29 ]. En ocasiones, las petequias acrales o la púrpura son las
manifestaciones cutáneas primarias de esta enfermedad [ 29 ].
Manifestaciones orales: la afectación de la mucosa oral es rara. Dado
que la mayoría de los informes que documentan la afectación oral en la DH no
han confirmado el diagnóstico mediante microscopía de inmunofluorescencia
directa, existe cierta incertidumbre sobre si algunos casos han representado
realmente estomatitis aftosa u otros trastornos [ 18 ]. La afectación de la
mucosa oral puede manifestarse como vesículas, erosiones o máculas eritematosas
en la mucosa oral o la lengua. El malestar puede estar presente o no.
Al igual que con la enfermedad celíaca, los defectos
del esmalte dental pueden ocurrir en pacientes con DH. Los pacientes pueden
presentar surcos horizontales, hoyos o decoloración [ 18 ]. En una serie de 30
adultos con DH, el 53 por ciento tenía defectos del esmalte en comparación con
sólo el 2 por ciento de 66 controles sanos [ 30 ]. Una serie de 10 niños con DH
y sin síntomas clínicos de enfermedad celíaca también encontró una tasa elevada
de anomalías dentales entre los pacientes con DH; El 80 por ciento tenía
defectos bilaterales del esmalte, mientras que se observaron defectos similares
en sólo el 13 por ciento de los niños sanos [ 31 ].
Enfermedad gastrointestinal: casi todos los pacientes con DH (75 a 90 por
ciento) tienen enfermedad subclínica o clínica asociada del intestino delgado
relacionada con la sensibilidad al gluten [ 11,32 ]. Los hallazgos de la
biopsia del intestino delgado pueden demostrar la atrofia de las vellosidades e
hiperplasia de las criptas clásicamente asociadas con la enfermedad celíaca;
otros casos pueden mostrar sólo hallazgos leves, como un aumento de los
linfocitos intraepiteliales en las microvellosidades intestinales [ 33 ].
A pesar de la presencia común de anomalías
histológicas en el intestino, solo una minoría de pacientes con DH desarrolla
síntomas gastrointestinales clínicamente significativos. Los pacientes
sintomáticos pueden presentar distensión abdominal, calambres, dolor, diarrea o
estreñimiento.
Evolución clínica: la DH suele ser una afección de por vida. Sin
embargo, el curso clínico de la enfermedad de la piel es variable. Mientras que
algunos pacientes experimentan erupciones intermitentes que duran sólo unos
pocos días y están separados por largos períodos asintomáticos, otros
desarrollan síntomas continuos que aumentan y disminuyen en gravedad [ 34 ].
Ocasionalmente, se producen remisiones espontáneas [ 35 ].
ENFERMEDADES ASOCIADAS
Además de la enfermedad celíaca, otras enfermedades
pueden ocurrir con mayor frecuencia en pacientes con DH. La afección asociada
más común es la enfermedad tiroidea autoinmune [ 33 ]. A modo de ejemplo, en un
estudio retrospectivo de 264 adultos con DH, se documentó enfermedad tiroidea
en el 11% [ 33 ]. Es más probable que ocurra hipotiroidismo que hipertiroidismo
[ 33,36,37 ].
La diabetes mellitus tipo I y la anemia perniciosa
también pueden ser más propensas a desarrollarse en pacientes con DH. Se estima
que la prevalencia de diabetes mellitus tipo 1 en pacientes con DH se sitúa
entre el 2 y el 5% [ 18 ]. Entre el 1 y el 3 por ciento de los pacientes con DH
pueden tener anemia perniciosa [ 33 ]. Otras enfermedades que pueden ocurrir
con mayor frecuencia en pacientes con DH incluyen vitíligo, enfermedad de
Addison, alopecia areata y varias otras enfermedades autoinmunes [ 33,37 ].
La enfermedad celíaca se ha asociado con un mayor
riesgo de linfoma no Hodgkin [ 38 ]. También puede ocurrir un aumento del
riesgo de linfoma en asociación con DH, aunque las estimaciones de este riesgo
han variado [ 39-45 ]. Como ejemplo, un estudio poblacional sueco que incluyó a
1354 pacientes con DH encontró un riesgo general ligeramente mayor de cáncer
(índice de incidencia estándar [SIR] 1.2, IC del 95%: 1.0-1.4), que apareció
principalmente debido a un aumento en el linfoma. y leucemia [ 39]. Además, un
estudio de cohorte en el Reino Unido que incluyó a 84 pacientes con DH que
fueron seguidos durante una media de 22 años encontró que el riesgo de linfoma
no Hodgkin aumentó en comparación con la población general (SIR 5.14, IC 95%
1.05 -15,0) [ 40 ]. En este estudio, el riesgo general de malignidad no aumentó
(SIR 0,99, IC del 95%: 0,65-1,44).
El impacto de una dieta sin gluten sobre el riesgo
de malignidad en pacientes con DH es incierto. Un estudio retrospectivo sugirió
una reducción del riesgo de linfoma entre los pacientes con antecedentes de
adherencia a largo plazo a una dieta sin gluten [ 46 ]. Sin embargo, se
necesitan estudios adicionales para explorar el impacto de una dieta sin gluten
en el riesgo de malignidad.
DIAGNÓSTICO
Además del reconocimiento de hallazgos clínicos
consistentes, la obtención de estudios de laboratorio, incluida la patología
tisular, la microscopía de inmunofluorescencia directa (DIF) y la serología
pueden ayudar en el diagnóstico de DH. DIF se considera la prueba estándar de
oro para el diagnóstico.
Nuestro enfoque inicial para el diagnóstico de DH en
pacientes que presentan hallazgos clínicos sugestivos implica obtener una
biopsia de piel de la lesión para tinción de rutina con hematoxilina y eosina
(H&E) y una biopsia de piel perilesional para DIF. Usamos estudios
serológicos como pruebas complementarias para respaldar el diagnóstico. La
serología también puede ser útil para evaluar la adherencia a la terapia
dietética.
Histopatología:
una biopsia con sacabocados de 4 mm suele ser suficiente para obtener
una muestra de tejido para el examen histológico de rutina. Idealmente, la
muestra de biopsia debe tomarse del sitio de una vesícula pequeña e intacta. Si
no hay vesículas intactas, la biopsia debe tomarse de un área de piel inflamada
intacta. Las biopsias de lesiones excoriadas pueden producir hallazgos
inespecíficos.
Los hallazgos histológicos varían según la edad de
la lesión. Las primeras lesiones pueden mostrar sólo acumulaciones de
neutrófilos (con o sin eosinófilos) y fibrina en las puntas de las papilas
dérmicas (microabscesos papilares) [ 47 ]. Las lesiones mayores de 48 horas
comienzan a mostrar vesiculación subepidérmica en las puntas papilares, que
eventualmente se conectan para formar ampollas subepidérmicas más grandes que
contienen neutrófilos, eosinófilos y fibrina (imagen 7). En la dermis suele
encontrarse un infiltrado linfohistiocítico perivascular con un número variable
de neutrófilos y eosinófilos [ 47 ].
Imagen 7: dermatitis herpetiforme
Hay presencia de ampollas subepidérmicas,
microabscesos neutrofílicos y un infiltrado inflamatorio perivascular.
Los hallazgos histológicos en la DH pueden parecerse
a los de otros trastornos ampollosos subepiteliales. En particular, la DH puede
ser difícil de distinguir de la dermatosis ampollosa por IgA lineal y del lupus
eritematoso sistémico ampolloso. El penfigoide ampolloso también puede
parecerse a la DH desde el punto de vista histológico, pero típicamente se
caracteriza por una mayor abundancia de eosinófilos [ 47 ].
Microscopía de inmunofluorescencia directa: DIF es la prueba estándar de oro para el
diagnóstico de DH. Por lo general, se utiliza una biopsia con sacabocados de 4
mm para obtener la muestra de tejido. La biopsia debe tomarse de la piel
perilesional (piel de apariencia normal adyacente a una lesión) porque es más
probable que las biopsias tomadas de la piel de la lesión arrojen resultados
negativos falsos [ 48 ]. El medio de Michel se puede utilizar para transportar
la muestra. El tejido para DIF no debe colocarse en formalina.
El hallazgo característico en DIF es la presencia de
depósitos granulares de inmunoglobulina A (IgA) dentro de las papilas dérmicas
(imagen 8). También pueden estar presentes depósitos de inmunoglobulina M (IgM)
y C3 [ 47 ]. Con poca frecuencia, se detecta un patrón fibrilar, en lugar de
granular, de depósito de IgA [ 49,50 ].
Imagen 8: Microscopía de inmunofluorescencia directa
en dermatitis herpetiforme.
La microscopía de inmunofluorescencia directa de una
muestra perilesional de un paciente con dermatitis herpetiforme muestra
depósitos granulares de IgA dentro de la dermis papilar.
Los depósitos granulares de IgA a lo largo de la
membrana basal también se pueden ver en la DH y pueden llevar a un diagnóstico
erróneo de DH como dermatosis ampollosa por IgA lineal (imagen 9) [ 51,52 ].
Los estudios serológicos son útiles para aclarar el diagnóstico en casos ambiguos.
Imagen 9: Microscopía de inmunofluorescencia directa
en dermatitis herpetiforme
Aunque los depósitos granulares de IgA dentro de la
dermis papilar son los hallazgos clásicos de inmunofluorescencia directa en la
dermatitis herpetiforme, también pueden observarse depósitos granulares de IgA
a lo largo de la zona de la membrana basal.
DIF suele ser positivo en DH. En un estudio
retrospectivo de 264 pacientes con DH, DIF fue positivo en 244 pacientes (92
por ciento) [ 33 ]. El DIF puede volverse negativo en pacientes con dietas
estrictas sin gluten ya que la adherencia a la dieta reduce los depósitos de
IgA en la dermis. En una serie retrospectiva, 10 de 41 pacientes con DH que
seguían dietas estrictas sin gluten ya no tenían depósitos de IgA detectables
en la piel después de una media de 13 años [ 53 ]. El depósito de IgA no se ve
afectado por la terapia farmacológica [ 54 ].
Serología:
obtenemos estudios serológicos para confirmar el diagnóstico de DH en
pacientes con hallazgos clínicos, histológicos y DIF consistentes y para ayudar
en el diagnóstico de DH en los casos en los que DIF es negativo o equívoco. Los
niveles elevados de anticuerpos transglutaminasa tisular IgA, anticuerpos
transglutaminasa epidérmica IgA y anticuerpos endomisiales IgA suelen estar
presentes en el suero del paciente [ 33,55-59 ].
La serología también es útil para el seguimiento
clínico. Los niveles séricos de estos anticuerpos disminuyen con la restricción
de gluten y pueden ser útiles para controlar la adherencia y la respuesta a una
dieta sin gluten [ 60 ].
Las pruebas serológicas utilizadas en la DH son
generalmente sensibles y específicas. La sensibilidad del ensayo
inmunoabsorbente ligado a enzimas (ELISA) para anticuerpos transglutaminasa
tisular IgA oscila entre el 47 y el 95 por ciento, y se informa que la
especificidad de esta prueba es superior al 90 por ciento [ 51 ]. La
sensibilidad de ELISA para anticuerpos transglutaminasa epidérmicos IgA oscila
entre el 60 y el 81 por ciento, y la especificidad para esta prueba está entre
el 93 y el 100 por ciento [ 54,60 ].
El endomisio es el tejido conectivo que se encuentra
en el músculo liso del esófago, el estómago y el intestino delgado. La prueba
de anticuerpos endomisiales se realiza mediante inmunofluorescencia indirecta
en el esófago de mono [ 54 ]. La sensibilidad de esta prueba para la enfermedad
celíaca y la DH varía del 52 al 100 por ciento y la especificidad de la prueba
se aproxima al 100 por ciento [ 51 ].
Nuestro estudio serológico típico para pacientes con
sospecha de DH incluye lo siguiente:
- Ensayo inmunoabsorbente ligado a enzimas (ELISA) para anticuerpos transglutaminasa tisular IgA
- ELISA para anticuerpos transglutaminasa epidérmica IgA (cuando esté disponible)
- Inmunofluorescencia indirecta para anticuerpos endomisiales IgA
- Nivel de IgA total
El nivel total de IgA es necesario porque la deficiencia
selectiva de IgA, que disminuye la probabilidad de detectar transglutaminasa
IgA y autoanticuerpos endomisiales, se produce con mayor frecuencia en
pacientes con enfermedad celíaca [ 54 ]. La deficiencia de IgA parece ser menos
común en DH [ 61 ]. La evaluación de los anticuerpos de inmunoglobulina G (IgG)
contra la transglutaminasa tisular y el endomisio puede ser útil en este
contexto [ 54 ].
EXÁMENES ADICIONALES
Dado que la DH se considera una manifestación
cutánea de la enfermedad celíaca y el tratamiento de ambos trastornos es
similar (una dieta sin gluten), no está indicada la realización de una biopsia
del intestino delgado para confirmar la patología intestinal [ 54,62 ].
Debido a la asociación de DH con enfermedad
tiroidea, normalmente obtenemos pruebas de función tiroidea en pacientes con DH
[ 54 ]. También evaluamos a los pacientes en busca de diabetes. Se pueden
solicitar pruebas adicionales basadas en la sospecha clínica de otras
enfermedades autoinmunes.
DIAGNÓSTICO DIFERENCIAL
Las características clínicas de la DH pueden parecerse
a los hallazgos clínicos de otros trastornos dermatológicos. Deben considerarse
las afecciones intensamente pruriginosas que cursan con excoriaciones y pápulas
inflamatorias, como dermatitis atópica, sarna y picaduras de artrópodos.
Otras enfermedades ampollosas subepidérmicas como el
penfigoide ampolloso (imagen 10), dermatosis ampollosa por IgA lineal (imagen
11,12), y el lupus eritematoso sistémico ampolloso también se incluyen en el
diagnóstico diferencial. Las ampollas tienden a ser más prominentes en estas
condiciones que en DH. Sin embargo, en la fase prodrómica del penfigoide
ampolloso, la formación de ampollas puede ser mínima o estar ausente.
Imagen 10: Penfigoide ampolloso
Múltiples placas eritematosas, ampollas, erosiones y
costras en la piel del tronco y las extremidades.
Imagen 11: Dermatosis ampollosa por IgA lineal
Hay múltiples vesículas inflamatorias y costras en
la extremidad.
Imagen 12: Dermatosis ampollosa por IgA lineal
Bullas tensas, erosiones y costras, a menudo en un
patrón descrito como "racimos de joyas" o "cadenas de
perlas" ("clusters of jewels" or "strings of pearls”),, en
la piel de un paciente con dermatosis ampollosa por IgA lineal.
La evaluación cuidadosa de la historia del paciente,
así como los hallazgos clínicos, histopatológicos, inmunopatológicos y
serológicos, generalmente distingue con éxito la DH de otros trastornos.
TRATAMIENTO
Las dos intervenciones terapéuticas más importantes
para la DH incluyen una dieta estricta sin gluten y la terapia con dapsona [
63-65 ]. Una dieta sin gluten es eficaz tanto para la DH como para la
enteropatía sensible al gluten asociada a menudo. Sin embargo, pueden ser
necesarios varios meses o algunos años para lograr la remisión completa de la
DH con una dieta libre de gluten como monoterapia [ 11,63 ].
A diferencia de una dieta sin gluten, la dapsona es
rápidamente eficaz para la DH, lo que resulta en la resolución de las lesiones
cutáneas activas a los pocos días del inicio de la terapia. Las desventajas de
la terapia con dapsona incluyen la posibilidad de reacciones adversas
relacionadas con el fármaco y su falta de efecto sobre las manifestaciones
gastrointestinales de la sensibilidad al gluten [ 63 ].
Nuestro enfoque preferido para el tratamiento de la
DH consiste en un régimen combinado que permite a los pacientes beneficiarse de
las características favorables de ambas intervenciones. Al inicio del
tratamiento, prescribimos dapsona para inducir una rápida desaparición de los
síntomas y, al mismo tiempo, animamos a los pacientes a eliminar el gluten de sus
dietas. Luego, gradualmente disminuimos la dapsona según la tolerancia, con el
objetivo de mantener finalmente la mejora clínica solo con la terapia
dietética.
Indicaciones de derivación: los pacientes suelen ser tratados por un
dermatólogo (para el tratamiento de la DH) y un nutricionista (para
asesoramiento dietético) [ 32 ]. Se agregan especialistas adicionales según sea
necesario en función de las comorbilidades del paciente (p. Ej., Enfermedad de
la tiroides, diabetes).
Terapia de primera línea -
terapia de primera línea para DH consiste tanto dapsona y la eliminación
de gluten de la dieta.
Dapsona: la
eficacia de la dapsona en DH está bien aceptada sobre la base de una amplia
experiencia clínica y la clara correlación con una rápida mejoría clínica
inmediatamente después del inicio del tratamiento [ 11,54,62,63,65,66 ]. El
prurito suele mejorar en 72 horas y las manifestaciones cutáneas suelen
resolverse en días [ 18 ]. Ningún ensayo aleatorizado ha evaluado la eficacia
de la dapsona en la DH.
En adultos con DH, el tratamiento con dapsona
generalmente se inicia con 25 a 50 mg por día. La dosis se ajusta lentamente
hacia arriba (p. Ej., Un aumento de 25 mg en la dosis diaria cada una o dos
semanas hasta una dosis de 2 mg / kg por día) según la tolerancia del paciente
y la respuesta al tratamiento. Nuestra experiencia sugiere que la mayoría de
los pacientes adultos con dietas sin restricciones responden completamente a
dosis entre 50 y 150 mg por día [ 67 ]. Se esperan erupciones leves (p. Ej.,
Una o dos lesiones nuevas por semana) con la dosis óptima y no son una
indicación para aumentar la dosis de dapsona. Los síntomas de estos brotes
leves se pueden tratar con la aplicación de un corticosteroide tópico potente.
La terapia con dapsona se asocia con una variedad de
efectos adversos potenciales (tabla 1). Se produce cierto grado de hemólisis en
prácticamente todos los pacientes. Aunque la mayoría de los pacientes tolera
esto, las personas con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD)
tienen mayor riesgo de anemia hemolítica grave. Ejemplos de efectos secundarios
adicionales incluyen metahemoglobinemia, agranulocitosis y una reacción de
hipersensibilidad a la dapsona. Cuando ocurre, la agranulocitosis suele
aparecer de 2 a 12 semanas después del inicio de la terapia con dapsona. El
síndrome de hipersensibilidad asociado a la dapsona se presenta clásicamente
con síntomas similares a los de la gripe, erupción cutánea morbiliforme,
fiebre, linfadenopatía, hepatitis y eosinofilia.
Tabla 1. Efectos adversos de la dapsona.
Es necesario un control de laboratorio cuidadoso
durante la terapia con dapsona . Por lo general, obtenemos un hemograma
completo (CBC), pruebas de función hepática y pruebas de función renal antes
del inicio de la terapia. También se recomienda una prueba de detección de
G6PD, ya que la terapia con dapsona está contraindicada en pacientes con
deficiencia de G6PD. Repetimos un CBC cada una a tres semanas durante un mes, y
cada uno a tres meses durante los primeros seis meses de terapia.
Posteriormente, obtenemos un hemograma completo cada tres a seis meses siempre
que no se aumente la dosis de dapsona. Las pruebas de función hepática y renal
se realizan cada tres o cuatro meses.
Se puede intentar una disminución gradual y lenta de
la dapsona después de que el paciente haya seguido una dieta estricta sin
gluten durante al menos dos o tres meses [ 68 ]. Disminuir demasiado rápido
puede provocar brotes de enfermedades. No se ha determinado cuál es el mejor
régimen para reducir la dosis de dapsona. Por lo general, intentamos reducir el
medicamento en 25 mg cada cuatro a seis semanas. En un estudio, la reducción de
la dapsona hasta el cese del tratamiento requirió una media de dos años [ 69 ].
Dieta sin gluten:
la designación de una dieta sin gluten como tratamiento de primera línea
para la DH se basa en estudios no controlados y una amplia experiencia clínica
que respalda su beneficio en la DH y la doble eficacia de la dieta para las
manifestaciones cutáneas y gastrointestinales de sensibilidad al gluten [
53,63,69-73 ]. Aunque la dapsona es muy eficaz para inducir remisiones clínicas
de DH, una dieta sin gluten es nuestra opción preferida para la terapia a largo
plazo.
Los pacientes que se adhieren a una dieta libre de
gluten generalmente pueden reducir el requerimiento de dapsona y eventualmente
pueden descontinuar la terapia con dapsona. A modo de ejemplo, en un estudio de
36 meses de 81 pacientes con DH que siguieron una dieta sin gluten durante 6 a
36 meses y 49 pacientes con DH que mantuvieron una dieta normal, se lograron
reducciones en la dosis de dapsona en 93 frente a El 16 por ciento de los
pacientes, respectivamente [ 69]. Después de un año, la reducción promedio en
la dosis de dapsona en pacientes con una dieta libre de gluten fue del 60 por
ciento; la reducción porcentual aumentó al 80 por ciento después de tres años.
Durante el período de estudio, el 28 por ciento de los pacientes con una dieta
sin gluten pudieron suspender la dapsona por completo. Entre estos pacientes,
el tiempo medio necesario para interrumpir la dapsona fue de dos años.
La adherencia estricta a una dieta libre de gluten
es un desafío. Se recomienda la asesoría de un dietista para ayudar a los
pacientes a identificar y eliminar las fuentes obvias y ocultas de gluten en la
dieta y ayudar a los pacientes a encontrar alternativas a los alimentos que
contienen gluten. Se encuentran disponibles múltiples recursos que brindan
información sobre dietas sin gluten. Los ejemplos incluyen la Celiac Disease
Foundation y el Gluten Intolerance Group . No está claro si una dieta sin
gluten reduce el riesgo de enfermedades autoinmunes y malignidad en pacientes
con DH.
Si se produce una recaída de DH en un paciente con
una dieta estricta sin gluten, se debe considerar la posibilidad de exposición
a fuentes ocultas de gluten u otros desencadenantes (yoduro, medicamentos). Una
revisión minuciosa de la dieta con un dietista puede identificar fuentes no
intencionales de ingesta de gluten. Para las recidivas graves, la dapsona puede
reiniciarse con el mismo régimen utilizado para la terapia inicial.
Otras terapias
Otros medicamentos a base de sulfamidas: en pacientes que no pueden tolerar el
tratamiento con dapsona , otros medicamentos de sulfonamida son opciones para
la farmacoterapia. Sin embargo, hay mucha menos experiencia con el uso de estas
terapias.
Los informes de casos documentan el tratamiento
exitoso de la DH con sulfapiridina [ 74,75 ] y sulfasalazina [ 76-78 ]. Aunque
la sulfasalazina se metaboliza a sulfapiridina en el intestino, la absorción de
sulfapiridina (el fármaco activo) es más predecible cuando se administra
sulfapiridina [ 76,79 ]. Por tanto, nuestra preferencia es utilizar
sulfapiridina. Se puede administrar sulfapiridina a adultos en una dosis
inicial de 0,5 g tres veces al día, que puede aumentarse hasta 6 g por día si
es necesario para controlar los síntomas del paciente. Se ha informado que la
sulfasalazina es eficaz en dosis entre 1 y 2 g por día [ 76 ].
De estos dos agentes, solo la sulfasalazina está
disponible comercialmente en los Estados Unidos. La sulfapiridina se puede
obtener a través de farmacias de compuestos.
Aunque la sulfapiridina y la sulfasalazina no causan
la hemólisis observada con la terapia con dapsona , la agranulocitosis y las
reacciones de hipersensibilidad son efectos adversos potenciales. Además, se
recomienda una ingesta adecuada de líquidos durante el tratamiento con estos
fármacos para reducir el riesgo de nefrolitiasis inducida por fármacos. Al
igual que con la dapsona, la monitorización de laboratorio debe realizarse
periódicamente. Por lo general, seguimos un hemograma completo, un panel de función
hepática y un análisis de orina.
También se ha informado que la sulfametoxipiridazina
es eficaz para la DH [ 80,81 ]. Este agente no está disponible en los Estados
Unidos.
Corticosteroides: los corticosteroides superpotentes tópicos pueden
ayudar a aliviar el prurito. Estos agentes no son suficientes para el manejo de
la DH y deben usarse junto con dapsona y una dieta libre de gluten. Los
glucocorticoides sistémicos suelen ser ineficaces para la DH.
Tratamiento de niños: al igual que con los adultos, el tratamiento de
niños con DH generalmente consiste en dapsona y una dieta libre de gluten. La
dapsona generalmente se inicia a una dosis baja (<0,5 mg / kg por día) y se
ajusta hacia arriba según se tolere; la dosis terapéutica suele estar entre 0,5
y 2 mg / kg por día [ 82 ]. A medida que la dieta sin gluten comienza a surtir
efecto, la dapsona se reduce gradualmente según la tolerancia [ 83 ].
La duración del tiempo hasta la mejoría sin
tratamiento con dapsona se evaluó en un estudio en el que se trató a 41 niños
con DH únicamente con una dieta libre de gluten [ 11 ]. El estudio encontró que
33 de 41 niños (80 por ciento) tratados con una dieta libre de gluten solo
resolvieron sus síntomas en uno a seis meses. Sin embargo, dado que el alivio
que se obtiene con la dapsona es casi inmediato, normalmente utilizamos una
terapia combinada.
PRONÓSTICO
Muy a menudo, la DH es una afección de por vida que
requiere un tratamiento continuo con dapsona y / o una dieta libre de gluten
para mantener la remisión. Los síntomas pueden reaparecer dentro de los dos
días posteriores a la interrupción de la dapsona y dentro de los tres meses
posteriores a la reanudación de la ingesta de gluten [ 62,66 ]. Sin embargo,
del 10 al 15 por ciento de los pacientes pueden desarrollar remisiones que
persisten a pesar de la interrupción del tratamiento farmacológico y dietético
[ 35,53 ].
A diferencia de la enfermedad celíaca, que puede
estar asociada con un mayor riesgo de mortalidad en comparación con la población
general, los pacientes con DH pueden tener una tasa de mortalidad reducida [
45,84 ]. Un estudio de cohorte finlandés de 476 pacientes con DH encontró una
tasa de mortalidad inferior a la esperada por todas las causas a pesar de un
aumento significativo de la tasa de mortalidad estandarizada por neoplasias
linfoproliferativas en los primeros cinco años de seguimiento [ 84 ]. Son
necesarios más estudios para aclarar los factores que pueden contribuir a una
reducción de la mortalidad.
REFERENCIAS
Reunala T, Lokki J. Dermatitis herpetiformis en
Finlandia. Acta Derm Venereol 1978; 58: 505.
Mobacken H, Kastrup W, Nilsson LA. Incidencia y
prevalencia de dermatitis herpetiforme en el oeste de Suecia. Acta Derm
Venereol 1984; 64: 400.
Salmi TT, Hervonen K, Kautiainen H, et al.
Prevalencia e incidencia de dermatitis herpetiforme: un estudio prospectivo de
40 años de Finlandia. Br J Dermatol 2011; 165: 354.
Christensen OB, Hindsén M, Svensson A. Historia
natural de la dermatitis herpetiforme en el sur de Suecia. Dermatologica 1986;
173: 271.
Burrows D. La prevalencia de dermatitis
herpetiforme. Br J Dermatol 1972; 86: 437.
Buckley DB,
English J, Molloy W, et al. Dermatitis herpetiforme: revisión
de 119 casos. Clin Exp
Dermatol 1983; 8: 477.
Gawkrodger DJ,
Blackwell JN, Gilmour HM y col. Dermatitis
herpetiforme: diagnóstico, dieta y demografía. Gut 1984; 25: 151.
Moi H. Incidencia y prevalencia de dermatitis
herpetiforme en un país del centro de Suecia, con comentarios sobre la
evolución de la enfermedad y depósitos de IgA como criterio diagnóstico. Acta
Derm Venereol 1984; 64: 144.
Smith JB, Tulloch JE, Meyer LJ, Zone JJ. La
incidencia y prevalencia de dermatitis herpetiforme en Utah. Arch Dermatol 1992; 128: 1608.
West J, Fleming
KM, Tata LJ y col. Incidencia y prevalencia de la
enfermedad celíaca y la dermatitis herpetiforme en el Reino Unido durante dos
décadas: estudio poblacional. Am J Gastroenterol 2014; 109: 757.
Ermacora E, Prampolini L, Tribbia G y col.
Seguimiento a largo plazo de la dermatitis herpetiforme en niños. J Am Acad
Dermatol 1986; 15:24.
Bonciani D, Verdelli A, Bonciolini V, et al.
Dermatitis herpetiforme: desde la genética hasta el desarrollo de lesiones
cutáneas. Clin Dev Immunol
2012; 2012: 239691.
Spurkland A,
Ingvarsson G, Falk ES y col. La dermatitis herpetiforme y la
enfermedad celíaca se asocian principalmente con los heterodímeros HLA-DQ (alfa
1 * 0501, beta 1 * 02) o HLA-DQ (alfa 1 * 03, beta 1 * 0302). Tissue Antigens
1997; 49:29.
Forabosco P, Neuhausen SL, Greco L, et al.
Metaanálisis de estudios de ligamiento de genoma completo en la enfermedad
celíaca. Hum Hered 2009;
68: 223.
Hervonen K,
Hakanen M, Kaukinen K, et al. Los familiares de primer grado se
ven afectados con frecuencia en la enfermedad celíaca y la dermatitis
herpetiforme. Scand J Gastroenterol 2002; 37:51.
Meyer LJ, Zona JJ. Incidencia familiar de dermatitis
herpetiforme. J Am Acad Dermatol 1987; 17: 643.
Reunala T. Incidencia de dermatitis herpetiforme
familiar. Br J Dermatol 1996; 134: 394.
Bolotin D, Petronic-Rosic V. Dermatitis
herpetiforme. Parte I. Epidemiología, patogenia y presentación clínica. J Am
Acad Dermatol 2011; 64: 1017.
Marsh MN. Transglutaminasa, gluten y enfermedad
celíaca: tema de reflexión. La transglutaminasa se identifica como el
autoantígeno de la enfermedad celíaca. Nat Med 1997; 3: 725.
Caputo I, Barone MV, Martucciello S, et al.
Transglutaminasa tisular en la enfermedad celíaca: papel de los
autoanticuerpos. Amino Acids 2009; 36: 693.
Molberg O, Mcadam SN, Körner R y col. La
transglutaminasa tisular modifica selectivamente los péptidos de gliadina que
son reconocidos por las células T derivadas del intestino en la enfermedad
celíaca. Nat Med 1998; 4: 713.
Casco CM, Zona JJ. Dermatitis herpetiforme y
dermatosis ampollosa IgA lineal. En:
Dermatology, 3rd ed, Bolognia JL, Jorizzo JL, Schaffer JV, et al (Eds),
Elsevier Limited, 2012. Vol 1, p.491.
Hervonen K,
Karell K, Holopainen P, et al. Concordancia de dermatitis
herpetiforme y enfermedad celíaca en gemelos monocigotos. J Invest Dermatol
2000; 115: 990.
Cinats AK, Parsons LM, Haber RM. Afectación facial
en la dermatitis herpetiforme: reporte de un caso y revisión de la literatura. J Cutan Med Surg 2019; 23:35.
McCleskey PE,
Erickson QL, David-Bajar KM, Elston DM. Petequias palmar en
dermatitis herpetiforme: reporte de un caso y revisión clínica. Cutis 2002; 70:
217.
Flann S, Degiovanni C, Derrick EK, Munn SE. Dos
casos de petequias palmar como presentación de dermatitis herpetiforme. Clin Exp Dermatol 2010; 35: 206.
Heinlin J,
Knoppke B, Kohl E y col. Dermatitis herpetiforme que se presenta
como petequias digitales. Pediatr Dermatol 2012; 29: 209.
Hofmann SC, Nashan D, Bruckner-Tuderman L. Petequias
en las yemas de los dedos como síntoma de presentación de la dermatitis
herpetiforme de Duhring. J Eur Acad Dermatol Venereol 2009; 23: 732.
Tu H, Parmentier L, Stieger M, et al. La púrpura
acral como manifestación clínica principal de la dermatitis herpetiforme:
reporte de dos casos en adultos con revisión de la literatura. Dermatología
2013; 227: 1.
Aine L, Mäki M, Reunala T.Defectos del esmalte
dental de tipo celíaco en pacientes con dermatitis herpetiforme. Acta Derm
Venereol 1992; 72:25.
Aine L, Reunala T, Mäki M. Defectos del esmalte
dental en niños con dermatitis herpetiforme. J Pediatr 1991; 118: 572.
Kárpáti S. Una excepción dentro del grupo de
enfermedades ampollosas autoinmunes: la dermatitis herpetiforme, la dermopatía
sensible al gluten. Dermatol Clin 2011; 29: 463.
Alonso-Llamazares J, Gibson LE, Rogers RS 3ro.
Características clínicas, patológicas e inmunopatológicas de la dermatitis
herpetiforme: revisión de la experiencia de Mayo Clinic. Int J Dermatol 2007;
46: 910.
Kárpáti S. Dermatitis herpetiformis. Clin Dermatol
2012; 30:56.
Paek SY, Steinberg SM, Katz SI. Remisión en
dermatitis herpetiforme: un estudio de cohorte. Arch Dermatol 2011; 147: 301.
Gaspari AA,
Huang CM, Davey RJ y col. Prevalencia de anomalías tiroideas
en pacientes con dermatitis herpetiforme y en sujetos control con HLA-B8 /
-DR3. Am J Med 1990; 88: 145.
Kaplan RP, Callen JP. Dermatitis herpetiforme:
asociaciones de enfermedades autoinmunes. Clin Dermatol 1991; 9: 347.
Tio M, Cox MR, Eslick GD. Metaanálisis: enfermedad
celíaca y riesgo de mortalidad por todas las causas, cualquier malignidad y
malignidad linfoide. Aliment
Pharmacol Ther 2012; 35: 540.
Askling J, Linet
M, Gridley G, et al. Incidencia de cáncer en una cohorte
poblacional de individuos hospitalizados con enfermedad celíaca o dermatitis
herpetiforme. Gastroenterology
2002; 123: 1428.
Grainge MJ, West
J, Solaymani-Dodaran M, et al. El riesgo a largo plazo de
malignidad después de un diagnóstico de enfermedad celíaca o dermatitis
herpetiforme: un estudio de cohorte. Aliment Pharmacol Ther 2012; 35: 730.
Hervonen K, Vornanen M, Kautiainen H, et al. Linfoma
en pacientes con dermatitis herpetiforme y sus familiares de primer grado. Br J
Dermatol 2005; 152: 82.
Collin P, Pukkala E, Reunala T. Malignidad y
supervivencia en la dermatitis herpetiforme: una comparación con la enfermedad
celíaca. Gut 1996; 38: 528.
Sigurgeirsson B, Agnarsson BA, Lindelöf B. Riesgo de
linfoma en pacientes con dermatitis herpetiforme. BMJ 1994; 308: 13.
Leonard JN, Tucker WF, Fry JS y col. Mayor
incidencia de malignidad en la dermatitis herpetiforme. Br Med J (Clin Res Ed)
1983; 286: 16.
Viljamaa M, Kaukinen K, Pukkala E, et al. Neoplasias
y mortalidad en pacientes con enfermedad celíaca y dermatitis herpetiforme:
estudio poblacional de 30 años. Dig
Liver Dis 2006; 38: 374.
Lewis HM,
Renaula TL, Garioch JJ, et al. Efecto protector de la dieta sin
gluten contra el desarrollo de linfoma en dermatitis herpetiforme. Br J
Dermatol 1996; 135: 363.
Weedon D. El patrón de reacción vesicobulloso. En:
Patología de la piel de Weedon, 3ª ed, Elsevier, 2010. p.123.
Zona JJ, Meyer LJ, Petersen MJ. Deposición de IgA
granular en relación con las lesiones clínicas en la dermatitis herpetiforme. Arch Dermatol 1996; 132: 912.
Ko CJ, Colegio
OR, Moss JE, McNiff JM. Depósito fibrilar de IgA en la
dermatitis herpetiforme: un patrón poco informado con potencial importancia
clínica. J Cutan Pathol 2010; 37: 475.
Kawana S, Segawa A. Estudios microscópicos de
escaneo láser confocal y microscópicos inmunoelectrónicos de la distribución
anatómica de los depósitos fibrilares de IgA en la dermatitis herpetiforme.
Arch Dermatol 1993; 129: 456.
Bonciolini V, Bonciani D, Verdelli A, et al.
Característica clínica e inmunopatológica recientemente descrita de la
dermatitis herpetiforme. Clin Dev Immunol 2012; 2012: 967974.
Van L, Browning JC, Krishnan RS y col. Dermatitis
herpetiforme: potencial de confusión con dermatosis ampollosa por IgA lineal en
inmunofluorescencia directa. Dermatol Online J 2008; 14:21.
Garioch JJ, Lewis HM, Sargent SA, et al. 25 años de
experiencia con una dieta sin gluten en el tratamiento de la dermatitis
herpetiforme. Br J Dermatol 1994; 131: 541.
Bolotin D, Petronic-Rosic V. Dermatitis
herpetiforme. Parte II. Diagnóstico, manejo y pronóstico. J Am Acad Dermatol 2011; 64: 1027.
Sárdy M, Kárpáti
S, Merkl B, et al. La transglutaminasa epidérmica (TGasa 3)
es el autoantígeno de la dermatitis herpetiforme. J Exp Med 2002; 195: 747.
Hull CM, Liddle
M, Hansen N, et al. Elevación de anticuerpos
anti-transglutaminasa epidérmicos IgA en dermatitis herpetiforme. Br J Dermatol
2008; 159: 120.
Dieterich W, Laag E, Bruckner-Tuderman L, et al.
Anticuerpos contra la transglutaminasa tisular como marcadores serológicos en
pacientes con dermatitis herpetiforme. J Invest Dermatol 1999; 113: 133.
Borroni G, Biagi F, Ciocca O, et al. Autoanticuerpos
antiepidérmicos transglutaminasa IgA: un marcador sensible y sensible para el
diagnóstico de dermatitis herpetiforme en pacientes adultos. J Eur Acad
Dermatol Venereol 2013; 27: 836.
Rose C, Armbruster FP, Ruppert J y col. Los
autoanticuerpos contra la transglutaminasa epidérmica son un marcador de
diagnóstico sensible en pacientes con dermatitis herpetiforme con una dieta
normal o sin gluten. J Am Acad Dermatol 2009; 61:39.
Reunala T, Salmi TT, Hervonen K, et al. Anticuerpos
antiepidérmicos transglutaminasa IgA en la dermatitis herpetiforme: una
respuesta significativa pero no completa a un tratamiento con dieta sin gluten.
Br J Dermatol 2015; 172:
1139.
Samolitis NJ,
Hull CM, Leiferman KM, Zone JJ. Dermatitis herpetiforme
y deficiencia parcial de IgA. J Am Acad Dermatol 2006; 54: S206.
Caproni M, Antiga E, Melani L, et al. Directrices
para el diagnóstico y tratamiento de la dermatitis herpetiforme. J Eur Acad
Dermatol Venereol 2009; 23: 633.
Fry L, Leonard JN, Swain F, et al. Seguimiento a
largo plazo de la dermatitis herpetiforme con y sin abstinencia dietética de
gluten. Br J Dermatol 1982; 107: 631.
Zona JJ, Meyer LJ. Dermatitis herpetiforme. Immunol
Ser 1989; 46: 565.
Egan CA,
O'Loughlin S, Gormally S, Powell FC. Dermatitis
herpetiforme: una revisión de cincuenta y cuatro pacientes. Ir J Med Sci 1997;
166: 241.
Cardones AR, Hall RP 3er. Manejo de la dermatitis
herpetiforme. Immunol Allergy
Clin North Am 2012; 32: 275.
Sanders SW, Zona JJ. La relación entre la dosis de
dapsona, la concentración sérica y la gravedad de la enfermedad en la
dermatitis herpetiforme. Arzneimittelforschung 1986; 36: 146.
Collin P, Reunala T. Reconocimiento y manejo de las
manifestaciones cutáneas de la enfermedad celíaca: una guía para dermatólogos.
Am J Clin Dermatol 2003; 4:13.
Reunala T, Blomqvist K, Tarpila S, et al. Dieta sin
gluten en dermatitis herpetiforme. I. Respuesta clínica de las lesiones
cutáneas en 81 pacientes. Br J Dermatol 1977; 97: 473.
Nino M, Ciacci C, Delfino M. Una dieta sin gluten a
largo plazo como tratamiento alternativo en formas graves de dermatitis
herpetiforme. J Dermatolog Treat 2007; 18:10.
Encabezado RC, Paterson WD, McClelland DB, et al.
Respuesta clínica de las lesiones cutáneas de la dermatitis herpetiforme a una
dieta sin gluten. Br J
Dermatol 1976; 94: 509.
Frödin T, Gotthard
R, Hed J y col. Dieta sin gluten para la dermatitis
herpetiforme: el efecto a largo plazo sobre las manifestaciones cutáneas,
inmunológicas y yeyunales. Acta Derm Venereol 1981; 61: 405.
Mansikka E, Hervonen K, Kaukinen K y col. El desafío
del gluten induce la recaída de la piel y el intestino delgado en la dermatitis
herpetiforme a largo plazo tratada con dieta sin gluten. J Invest Dermatol
2019; 139: 2108.
COOPER MM. Sulfapiridina en dermatitis herpetiforme;
reporte de caso menor de 11 años de tratamiento continuo. US Armed Forces Med J
1958; 9: 907.
COSTELLO MJ. Sulfapiridina en el tratamiento de la
dermatitis herpetiforme. Arch
Derm Syphilol 1947; 56: 614.
Willsteed E, Lee
M, Wong LC, Cooper A. Sulfasalazina y dermatitis herpetiforme. Australas
J Dermatol 2005; 46: 101.
Goldstein BG, Smith JG Jr. Sulfasalazina en
dermatitis herpetiforme. J Am Acad Dermatol 1990; 22: 697.
Lowney ED. Uso de sulfasalazina en dermatitis
herpetiforme en jóvenes. Arch Dermatol 1978; 114: 1553.
Hall R. Dapsona. En: Terapia Dermatológica Integral,
Wolverton S (Ed), WB Saunders Co, 2001. p.230.
McFadden JP, Leonard JN, Powles AV y col.
Sulfametoxipiridazina para la dermatitis herpetiforme, la enfermedad por IgA lineal
y el penfigoide cicatricial. Br J Dermatol 1989; 121: 759.
PERRY HO, WINKELMANN RK. Reacciones adversas a la
sulfametoxipiridazina (kynex); su uso en el tratamiento de la dermatitis
herpetiforme. J Am Med Assoc 1959; 169: 127.
Lara-Corrales I, Pope E. Enfermedades ampollosas
autoinmunes en niños. Semin Cutan Med Surg 2010; 29:85.
Hervonen K, Salmi TT, Kurppa K, et al. Dermatitis
herpetiforme en niños: un estudio de seguimiento a largo plazo. Br J Dermatol
2014; 171: 1242.
Hervonen K, Alakoski A, Salmi TT y col. Reducción de
la mortalidad en la dermatitis herpetiforme: un estudio poblacional de 476
pacientes. Br J Dermatol 2012; 167: 1331.


















No hay comentarios:
Publicar un comentario