En este ejercicio clínico se presenta un caso que es
discutido por un médico internista al que se le van proporcionando datos de la
historia clínica en forma secuencial, y este analiza el cuadro a la luz de los
nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica
real de la medicina.
Un hombre de 35 años de edad se presentó al servicio
de urgencias después de tener un episodio de síncope mientras jugaba fútbol. La
pérdida de conciencia duró solo unos segundos y fue precedida por un breve
período de aturdimiento. Cuando recuperó la conciencia, no tenía náuseas,
diaforesis, dolor en el pecho o disnea. Él no resultó herido y no tuvo incontinencia
intestinal o vesical. Los testigos informaron que no hubo movimientos
tónico-clónicos. El paciente no tenía antecedentes de desmayos o mareos previos.
PONENTE
En la evaluación del síncope, la historia del
episodio es crítica; se debe prestar especial atención a cualquier síntoma que
haya ocurrido antes de la pérdida de conciencia, el contexto dentro del cual se
produjo el síncope y cualquier consecuencia (por ejemplo, lesión o confusión
post-ictal). El síncope neuralmente mediado o vasovagal se asocia típicamente
con un pródromo de náuseas, diaforesis y visión en túnel. En ausencia de pródromos, es más probable un diagnóstico de
síncope cardíaco, aunque la presencia de pródromos no descarta el síncope cardíaco. El
síncope cardíaco generalmente está relacionado con un gasto cardíaco
inadecuado, que puede ser consecuencia de una obstrucción del tracto de salida,
taquicardia o bradicardia. La aparición de una lesión traumática, aunque no es
específico, el síncope cardíaco. Sin
embargo, la ausencia de lesiones no descarta el síncope cardíaco.
El síncope vasovagal suele ser situacional, se
produce en asociación con actividades específicas (por ejemplo, tos o micción)
o con dolor, y generalmente ocurre cuando el paciente está de pie. Es atípico
que el síncope vasovagal ocurra cuando una persona está sentada o reclinada y
es aún más atípica durante el ejercicio, lo que respalda aún más el diagnóstico
de síncope cardíaco en este paciente. El estado mental normal del paciente en
la recuperación de la conciencia y la ausencia de incontinencia intestinal o de
vejiga argumentan contra una convulsión. El paciente no tuvo sacudidas
tónico-clónicas, pero su presencia en cualquier caso no son específica de
convulsiones como causa subyacente. Se debe obtener una historia más detallada
para identificar cualquier factor de riesgo de enfermedad cardíaca, incluidos
los antecedentes familiares de enfermedad cardíaca o muerte súbita.
EVOLUCIÓN
El paciente no tomaba medicamentos, no consumía tabaco
ni drogas ilícitas, y bebía alcohol solo ocasionalmente. Había nacido en
México, había emigrado a los Estados Unidos cuando era adolescente y vivía con
su esposa en el oeste de Massachusetts, donde trabajaba como granjero lechero.
No recordaba ninguna enfermedad importante de la infancia. Su abuela materna y
su tío materno habían muerto repentinamente a los 65 años de edad sin una conocida
enfermedad cardiovascular previa. Tenía cinco hermanos y tres hijos, todos
estaban bien.
PONENTE
El hecho de que el paciente no haya tomado
medicamentos elimina un punto de preocupación, ya que algunos medicamentos, en
particular los bloqueadores beta, los bloqueadores del canal de calcio, los
agentes antihipertensivos y los medicamentos que prolongan el QT, pueden causar
síncope. La ausencia de factores de riesgo para enfermedad coronaria argumenta
contra la isquemia miocárdica, y una infancia aparentemente saludable reduce el
índice de sospecha de cardiopatía congénita no diagnosticada. Aunque el
paciente tenía dos parientes que murieron repentinamente, ninguno de los dos
murió a edad temprana.
EVOLUCIÓN
En la presentación inicial, el paciente tenía signos
vitales normales, y el examen físico no era relevante. Un electrocardiograma
(ECG) era normal. La ecocardiografía mostró un corazón estructuralmente normal.
El paciente fue dado de alta con un monitor de eventos, y 2 semanas más tarde
tuvo un episodio de taquicardia monomórfica de complejo ancho, con una
frecuencia cardíaca de casi 300 latidos por minuto, mientras jugaba fútbol. En
ese momento, notó una leve disnea y molestias en el cuello, pero no informó
dolor en el pecho, palpitaciones o mareos. Fue admitido para una mayor
evaluación y manejo de su condición.
PONENTE
Las taquicardias monomórficas de complejo ancho
incluyen taquicardia supraventricular con conducción aberrante, taquicardia
supraventricular con preexcitación y taquicardia ventricular. Aunque la
taquicardia ventricular es la causa más común de taquicardia de complejo ancho,
en un paciente joven y sano, las taquicardias supraventriculares siguen siendo
una posibilidad clara. En general, sin embargo, se debe suponer que los pacientes
tienen taquicardia ventricular hasta que se demuestre lo contrario. Un
antecedente de enfermedad coronaria aumenta la probabilidad de taquicardia
ventricular, mientras que las anomalías cardíacas estructurales pueden
asociarse con una mayor probabilidad de preexcitación, taquicardia ventricular
o ambas. En consecuencia, se justifica la evaluación tanto de isquemia como de cardiopatía estructural en pacientes que
presentan taquicardia de complejo ancho.
En un paciente con taquicardia de complejo ancho sostenida,
hemodinámicamente estable, los hallazgos físicos que sugieren una disociación
auriculoventricular pueden ser diagnósticos. En la mayoría de los casos, sin
embargo, el diagnóstico se realiza sobre la base del ECG o pruebas invasivas.
Un hallazgo de disociación auriculoventricular en ECG es diagnóstico de
taquicardia ventricular; otras características, como el eje QRS, el ancho del
QRS y las características morfológicas, son informativas pero no definitivas.
Desafortunadamente, las grabaciones obtenidas por medio de monitoreo
ambulatorio rara vez brindan información
diagnóstica. En tales casos, la estimulación programada (un estudio
electrofisiológico) a menudo puede inducir la taquicardia, permitiendo el
diagnóstico definitivo y el tratamiento apropiado.
El curso clínico de este paciente subraya el riesgo
de dar de alta a un paciente con posible síncope cardíaco con un plan para el
monitoreo ambulatorio. La intensidad de la evaluación inicial del síncope
depende de la estratificación del riesgo clínico. En un paciente que presenta
síncope asociado al ejercicio, se debe realizar una prueba de esfuerzo como
parte de la evaluación inicial; en este paciente, una prueba de estrés podría
haber reproducido la arritmia en un entorno controlado.
EVOLUCIÓN
Los resultados de la angiografía coronaria fueron
normales. Un estudio electrofisiológico invasivo mostró una taquicardia
ventricular que se originaba en un foco endocardíaco e inferolateral en el
ventrículo izquierdo; un mapa de voltaje endocárdico no reveló cicatrices
significativas. Después de la ablación endocárdica por radiofrecuencia, ya no
se pudo inducir la taquicardia ventricular.
PONENTE
Al evaluar la taquicardia ventricular monomórfica,
la primera consideración es la presencia o ausencia de cardiopatía estructural.
En este paciente joven y saludable cuyo ecocardiograma mostró un corazón
estructuralmente normal, el principal diagnóstico es la taquicardia ventricular
idiopática, que con frecuencia ocurre con el ejercicio o el estrés emocional y
se explica más a menudo por un foco automático, aunque los circuitos
reentrantes que involucran las fibras de Purkinje también pueden producir
taquicardia ventricular idiopática. Tiende a ser paroxística y termina
espontáneamente y a menudo se asocia con latidos ventriculares prematuros del
mismo foco automático. El síncope no es típico de la taquicardia ventricular
idiopática, pero puede asociarse con esta. Aunque el sitio de origen más común
es el tracto de salida del ventrículo derecho, que da como resultado un patrón
de bloqueo de rama izquierda con un eje inferior, se pueden observar
taquicardias ventriculares idiopáticas inferolaterales. No hay hallazgos que
sugieran una causa más siniestra de arritmia, como la taquicardia ventricular
múltiple que involucra diferentes circuitos (lo que sugeriría procesos como la
sarcoidosis), un mapa electroanatómico que sugiere cicatrización marcada (que
se manifestaría como un nivel de voltaje reducido) o anormalidades
concomitantes de la conducción.
Dado que el paciente pasó su infancia en México, la
enfermedad de Chagas es una consideración importante. En la enfermedad de
Chagas, las anormalidades de la conducción (bloqueo de rama derecha o
hemibloque anterior izquierdo, bloqueo nodal auriculoventricular de alto grado,
disfunción del nódulo sinusal o una combinación de estas anormalidades de
conducción) a menudo preceden a otras anomalías. En ausencia de anomalías de la
conducción, la taquicardia ventricular idiopática sigue siendo el diagnóstico
más probable, pero debe considerarse como un diagnóstico de exclusión. La resonancia
magnética cardíaca (RMN), que tiene una mayor sensibilidad para detectar
anomalías más sutiles que la ecocardiografía, se debe considerar para descartar
una enfermedad cardíaca estructural. Aunque la isquemia se asocia con
taquicardia ventricular polimórfica y fibrilación ventricular en lugar de
arritmias ventriculares monomórficas, dada su alta prevalencia y la
disponibilidad inmediata de tratamientos, la isquemia debe descartarse en pacientes
con arritmias ventriculares nuevas. Como en este caso, el cateterismo cardíaco
se realiza a menudo en pacientes con taquicardia de complejo ancho, ya que se
puede utilizar para descartar enfermedades o anomalías de enfermedad o
anomalías obstructivas de arteria
coronaria.
EVOLUCIÓN
Una resonancia magnética cardíaca no mostró
anomalías además de las lesiones creadas por la ablación por radiofrecuencia.
En las pruebas de esfuerzo de ejercicio de seguimiento, el paciente logró 17.8
equivalentes metabólicos; tuvo frecuentes contracciones ventriculares
prematuras con las mismas características morfológicas que su taquicardia
ventricular, pero no hubo arritmia sostenida. Dado la ectopia continua, que fue
consistente con su arritmia clínica, y dado la naturaleza hemodinámicamente
significativa de esa arritmia, se tomó la decisión de colocar un desfibrilador
cardioversor implantable (CDI) antes del alta.
PONENTE
Mientras que los CDI están claramente indicados para
la prevención secundaria de eventos cardíacos relacionados con una cardiopatía
estructural, la taquicardia ventricular idiopática rara vez es una indicación
para la colocación de CDI, ya que estas arritmias generalmente no son letales y
en la mayoría de los casos pueden eliminarse mediante ablación con catéter. Sin
embargo, se deben considerar enfoques alternativos para el manejo de la
atención cuando existe la preocupación de que la arritmia vuelva a aparecer
después de un intento inicial de ablación; Las opciones incluyen un segundo
intento de ablación, particularmente si hay una carga ectópica sustancial o una
terapia farmacológica a largo plazo. La elección del agente farmacológico para
la supresión de las arritmias ventriculares depende en parte del mecanismo
propuesto de la taquicardia ventricular. Los betabloqueantes pueden prevenir la
taquicardia ventricular inducida por el ejercicio mediante la supresión de la
reentrada, la reducción del automatismo
o la reducción de la demanda de oxígeno del miocardio. Algunas taquicardias
ventriculares izquierdas idiopáticas son exquisitamente sensibles al
verapamilo; estas "taquicardias ventriculares sensibles a verapamilo"
son típicamente inducidas por el ejercicio y en casos clásicos se caracterizan
por un patrón de bloqueo de rama derecha con un eje superior. Se pueden
considerar los agentes antiarrítmicos (por ejemplo, amiodarona o sotalol), ya
que pueden reducir la carga de la arritmia y disminuir su velocidad. Algunos
pacientes son reacios a someterse a un tratamiento a largo plazo con
medicamentos. Al considerar las opciones de tratamiento, se deben analizar los
riesgos asociados con los medicamentos y con la colocación del CDI, este último
incluye descargas inapropiadas y trastorno de estrés postraumático.
EVOLUCIÓN
Un año más tarde, durante una relación sexual, el
paciente tuvo un episodio de taquicardia ventricular monomórfica, que se terminó
con un único shock de su CDI.
PONENTE
Dado la recurrencia de las arritmias ventriculares,
se debe considerar seriamente otra ablación con catéter. Aunque se podría
contemplar la terapia antiarrítmica, la ablación con catéter es preferible a la
siguiente intervención terapéutica, dado la corta edad del paciente. Se debe
repetir el ecocardiograma para reevaluar al paciente por cardiopatía
estructural, ya que la arritmia recurrente plantea la cuestión de si el
diagnóstico inicial de taquicardia ventricular idiopática fue incorrecto o
(aunque es mucho menos probable), si se pudo haber desarrollado una arritmia
diferente no relacionada. Desafortunadamente, la presencia de un CDI impide
repetir la resonancia magnética cardíaca, pero el mapeo de voltaje en el
laboratorio de electrofisiología puede ser muy informativo con respecto a la
carga de la cicatrización.
EVOLUCIÓN
Al ingreso, el paciente estaba afebril, con una frecuencia
cardíaca de 92 latidos por minuto, presión arterial de 125/66 mm Hg y una
saturación de oxígeno del 99% mientras respiraba aire ambiental. Los hallazgos
notables en el examen físico incluyeron un impulso precordial no desplazado y
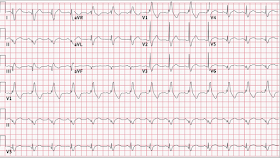
un segundo sonido del corazón ampliamente dividido sin soplos ni galope. Un ECG
reveló un bloqueo de rama derecha nuevo (Figura
1).
FIGURA 1
Electrocardiograma obtenido en la admisión, que
muestra el bloqueo de rama derecha y desviación del eje a la derecha.
Un ecocardiograma mostró un tamaño y grosor
ventricular izquierdo normal, con una función sistólica mínimamente reducida
(fracción de eyección, aproximadamente del 50 al 55%); era por lo demás normal.
Un estudio electrofisiológico mostró una gran cicatriz endocárdica y epicárdica
en la pared lateral del ventrículo izquierdo que era compatible con fibrosis miocárdica (Figura 2). Después de la
ablación endocárdica y epicárdica a lo largo de la cicatriz, la taquicardia
ventricular ya no era inducible.
FIGURA 2
Mapa electroanatómico que muestra la superficie
endocárdica del corazón del paciente.
La representación del corazón en la esquina inferior
derecha muestra la orientación. El voltaje normal en el mapa endocardial está
indicado por rosa; el voltaje es cada vez más anormal a medida que el color
cambia de azul a verde a rojo. El mapa revela una cicatriz significativa en la
pared lateral del ventrículo izquierdo. Las esferas rojas y blancas indican
puntos de ablación, y las esferas grises indican una cicatriz densa donde la
estimulación no puede capturar el tejido local.
PONENTE
El desarrollo de una nueva anormalidad estructural,
una cicatriz clínicamente significativa, sugiere una miocardiopatía progresiva.
Aunque la taquicardia ventricular puede provocar una depresión transitoria en
la función sistólica global, las anomalías observadas en el mapeo
electroanatómico no pueden atribuirse a la arritmia ni a la ablación anterior.
En ausencia de enfermedad coronaria, estos hallazgos sugieren ciertas
miocardiopatías, que incluyen sarcoidosis cardíaca, miocarditis de células
gigantes, cardiomiopatías genéticas y enfermedad de Chagas.
La causa de la enfermedad de Chagas es el parásito
protozoario Trypanosoma cruzi, que es endémico en América Central y del Sur. La
infección con T. cruzi debe sospecharse en personas que han emigrado de estas
áreas, incluido este paciente, que nació en México. Aunque la infección aguda a
menudo no se reconoce, la enfermedad crónica se desarrollará en hasta un 30% de
los pacientes con infección aguda. Un sello distintivo de la enfermedad crónica
es la miocardiopatía. Las anormalidades de conducción, como el bloqueo de rama
derecha observado en este paciente, son características de la enfermedad de
Chagas, y la afectación de la pared posterolateral del ventrículo izquierdo es
muy común.
La sarcoidosis cardíaca también puede causar
anomalías de la conducción y arritmias ventriculares, pero por lo general es un
proceso fragmentado que es menos probable que la enfermedad de Chagas produzca
una única gran región de fibrosis. No obstante, se debe considerar la
sarcoidosis en pacientes con arritmias ventriculares recurrentes inexplicables.
Cuando la sarcoidosis es una posibilidad, se debe realizar una RMN cardíaca
(que está contraindicada en este paciente debido a su CDI) o una tomografía de
emisión de positrones combinada y una tomografía computarizada (PET-TC). Otras
posibilidades menos probables incluyen la miocarditis de células gigantes, una
enfermedad autoinmune que ocasiona insuficiencia cardíaca grave y arritmias
ventriculares refractarias caracterizadas por un curso mucho más acelerado que
el observado en este paciente, y miocardiopatías genéticas, incluidas las
causadas por mutaciones en la lámina A (LMNA) y genes desmosomales.
EVOLUCIÓN
La PET-TC combinada con 18F-fluorodesoxiglucosa
(FDG) no mostró avidez por la FDG, pero reveló un defecto de perfusión
transmural que se extendía desde la pared basal a la lateral, sugiriendo la
formación de un aneurisma (Figura 3). Las pruebas para T. cruzi con un ensayo
de inmunofluorescencia y un ensayo de inmunoabsorción ligado a enzimas (ELISA)
fueron positivas. El paciente fue remitido a un especialista en enfermedades
infecciosas para el inicio de la terapia antiparasitaria y fue tratado con un
ciclo de 60 días de benznidazol. En el seguimiento 9 meses después, permaneció
sin síntomas.
FIGURA 3
Imágenes obtenidas con tomografía de emisión de
positrones con 18F-fluorodesoxiglucosa y TC, que muestran un defecto de
perfusión transmural en el corazón del paciente.
Las flechas apuntan al defecto de perfusión en la
pared del miocardio izquierda basal a mediolateral.
COMENTARIO
Aproximadamente 10 millones de personas en todo el
mundo están infectadas con T. cruzi, el parásito responsable de la enfermedad
de Chagas1, que es endémico en zonas rurales de América Latina.1,2 Aunque
históricamente la enfermedad de Chagas ha sido rara en los países
desarrollados, se espera que su prevalencia aumente en los Estados Unidos y
otros países desarrollados a medida que más personas emigran de regiones donde
la enfermedad es endémica.2
La enfermedad de Chagas crónica, cuyas señas de
identidad son cardiomiopatía, megaesófago y megacolon, ocurre en 10 a 30% de
las personas infectadas, generalmente se manifiesta de 10 a 30 años después de
la infección inicial.2 Predominan las manifestaciones cardíacas; las
manifestaciones gastrointestinales son mucho menos comunes y generalmente se
restringen a pacientes en la parte sur de Sudamérica. 3 El mecanismo del daño
cardíaco en la enfermedad de Chagas sigue siendo difícil de alcanzar. Los
factores incitantes pueden representar una respuesta a la persistencia de T.
cruzi dentro del miocardio o un proceso autoinmune desencadenado por su
presencia.1 Independientemente de la causa, la inflamación en curso da como
resultado una disfunción cardíaca progresiva.
En la enfermedad de Chagas, las arritmias y
anomalías de la conducción (en particular bloqueo de rama derecha, bloqueo
hemifascicular anterior izquierdo y taquicardia ventricular) suelen preceder a
la disfunción miocárdica evidente, el aneurisma apical y la disfunción
sistólica biventricular progresiva que culmina en insuficiencia cardíaca. 2,4
Los pacientes con enfermedad avanzada pueden morir por insuficiencia cardíaca,
mientras que aquellos con etapas cardíacas más tempranas pueden morir a causa
de una arritmia repentina. Este patrón de enfermedad de la conducción y la
arritmia que acompaña o precede a la cardiopatía estructural no es exclusivo de
la enfermedad de Chagas; también se puede observar en personas con enfermedades
isquémicas, inflamatorias, genéticas o infiltrativas.5 El diagnóstico de la
enfermedad de Chagas generalmente se basa en pruebas serológicas de anticuerpos
IgG contra antígenos de T. cruzi en un paciente con hallazgos clínicos de
apoyo. Ninguno de los ensayos disponibles (ELISA, ensayo de inmunofluorescencia
y ensayo de hemaglutinación) tiene sensibilidad y especificidad adecuadas para
el diagnóstico. Se requieren dos pruebas, en las cuales se usan diferentes
antígenos o técnicas, para hacer el diagnóstico; cuando los resultados son
discordantes, se deben realizar pruebas adicionales.3 Las posibles causas de
las manifestaciones clínicas distintas de la enfermedad de Chagas también deben
descartarse con pruebas apropiadas (p. ej., 18F-FDG PET-CT se usaría para
descartar sarcoidosis).
La mejor estrategia de manejo para la enfermedad
cardíaca crónica de Chagas sigue siendo incierta. La mayoría de las pautas de
manejo para la miocardiopatía de Chagas se extrapolan a partir de datos sobre
miocardiopatía dilatada isquémica y no isquémica.6 Debido a la naturaleza de
recursos escasos de las regiones en las que la enfermedad de Chagas es
endémica, los datos primarios se limitan a estudios retrospectivos y pequeños
registros. Mientras que la taquicardia ventricular sostenida es una indicación aceptada
para el implante de CDI 7, la tasa de mortalidad anual es alta entre los
pacientes con enfermedad de Chagas que tienen un desfibrilador cardioversor 8 y
existe incertidumbre con respecto a la eficacia de un desfibrilador
cardioversor comparado con amiodarona (el medicamento antiarrítmico preferido
para pacientes con miocardiopatía
Chagásica) .6,9 En pacientes con enfermedad de Chagas que han sufrido
taquicardia ventricular, la aparición de síncope no parece augurar un mal
pronóstico 10, pero la disfunción ventricular sistólica moderada o grave augura
un mal pronóstico para pacientes con taquicardia ventricular sostenida o no
sostenida11; la fracción de eyección relativamente preservada en este paciente
es tranquilizadora. El trasplante cardíaco se ha realizado con éxito en algunos
pacientes con enfermedad de Chagas.
Los medicamentos antitripanosómicos ahora se
utilizan en el tratamiento de la enfermedad de Chagas. Los datos
observacionales indican que su uso se asocia con una reducción en la
probabilidad de progresión de la miocardiopatía, aunque los problemas
gastrointestinales pueden no resolverse.1,3,12 El benznidazol y el nifurtimox
han establecido una eficacia antitripanosómica; ningún agente está ampliamente
disponible en los Estados Unidos.3,13,14 El benznidazol generalmente tiene
menos efectos secundarios que el nifurtimox y se recomienda como tratamiento de
primera línea3,12. Adultos menores de 50 años que tienen una infección aguda o
crónica sin enfermedad cardíaca avanzada debe generalmente tratarse con
medicamentos antitripanosómicos.3 Un ensayo aleatorizado, continuo y ciego de
benznidazol (ClinicalTrials.gov number, NCT00123916) debería aclarar aún más el
papel de los medicamentos antitripanosómicos en pacientes con infección crónica
de Chagas y afectación cardíaca.15 La anticoagulación no está indicada en
ausencia de trombos intracavitarios. 6
Mientras que la taquicardia ventricular idiopática
fue el diagnóstico más probable en el momento de la presentación inicial de
este paciente, las características clínicas de la arritmia recurrente y la
región de origen del paciente abogaron por un proceso más complicado. En estos
casos, es esencial realizar una reevaluación de la presencia de cardiopatía
estructural, que puede evolucionar con el tiempo. Este caso subraya la
importancia de tal reevaluación y de la consideración de enfermedades endémicas
de la región de origen del paciente.
Fuente:
A Patient with
Syncope
Michelle C. Fox,
M.D., Neal Lakdawala, M.D., Amy Leigh Miller, M.D., Ph.D.,
and Joseph
Loscalzo, M.D., Ph.D.
NEJM
REFERENCIAS
1Control of
Chagas' disease: second report of the WHO Expert Committee. Geneva: World
Health Organization, 2002.
2Rassi A Jr,
Rassi A, Marin-Neto JA. Chagas disease. Lancet 2010;375:1388-1402
CrossRef | Web of
Science | Medline
3Gayraud M,
Guillevin L, le Toumelin P, et al. Long-term follow-up of polyarteritis nodosa,
microscopic polyangiitis, and Churg-Strauss syndrome: analysis of four
prospective trials including 278 patients. Arthritis Rheum 2001;44:666-675
CrossRef | Web
of Science | Medline
4Rassi A Jr,
Rassi A, Little WC. Chagas' heart disease. Clin Cardiol 2000;23:883-889
CrossRef | Web
of Science | Medline
5Lakdawala NK,
Givertz MM. Dilated cardiomyopathy with conduction disease and arrhythmia.
Circulation 2010;122:527-534
CrossRef | Web
of Science | Medline
6Andrade JP, Marin Neto JA, Paola AA, et al. I Latin American guidelines for the diagnosis and
treatment of Chagas' heart disease: executive summary. Arq
Bras Cardiol 2011;96:434-442
CrossRef | Medline
7Muratore CA, Batista Sa LA, Chiale PA, et al. Implantable cardioverter defibrillators and Chagas'
disease: results of the ICD Registry Latin America. Europace 2009;11:164-168
CrossRef | Web
of Science | Medline
8Cardinalli-Neto A, Bestetti RB, Cordeiro JA,
Rodrigues VC. Predictors of
all-cause mortality for patients with chronic Chagas' heart disease receiving
implantable cardioverter defibrillator therapy. J Cardiovasc Electrophysiol
2007;18:1236-1240
CrossRef | Web
of Science | Medline
9Rassi A Jr. Implantable
cardioverter-defibrillators in patients with Chagas heart disease:
misperceptions, many questions and the urgent need for a randomized clinical
trial. J Cardiovasc Electrophysiol 2007;18:1241-1243
CrossRef | Web
of Science | Medline
10Leite LR,
Fenelon G, Paes AT, de Paola AA. The impact of syncope during clinical
presentation of sustained ventricular tachycardia on total and cardiac
mortality in patients with chronic Chagasic heart disease. Arq Bras Cardiol
2001;77:439-452
Medline
11Sarabanda AV, Marin-Neto JA. Predictors of mortality in patients with Chagas'
cardiomyopathy and ventricular tachycardia not treated with implantable
cardioverter-defibrillators. Pacing Clin Electrophysiol 2011;34:54-62
CrossRef | Web
of Science | Medline
12Bern C, Montgomery
SP, Herwaldt BL, et al. Evaluation and treatment of Chagas disease in the
United States: a systematic review. JAMA 2007;298:2171-2181
CrossRef | Web
of Science | Medline
13Viotti R, Vigliano C, Lococo B, et al. Long-term cardiac outcomes of treating chronic Chagas
disease with benznidazole versus no treatment: a nonrandomized trial. Ann
Intern Med 2006;144:724-734
CrossRef | Web
of Science | Medline
14Viotti R, Vigliano C, Lococo B, et al. Side effects of benznidazole as treatment in chronic
Chagas disease: fears and realities. Expert Rev Anti Infect Ther 2009;7:157-163
CrossRef | Web
of Science | Medline
15Marin-Neto JA, Rassi A Jr, Avezum A Jr, et al. The BENEFIT trial: testing the hypothesis that trypanocidal
therapy is beneficial for patients with chronic Chagas heart disease. Mem Inst
Oswaldo Cruz 2009;104:Suppl 1:319-324[Erratum, Mem Inst Oswaldo Cruz
2009;104:937.]
CrossRef | Web
of Science | Medline


No hay comentarios:
Publicar un comentario