Espacio virtual creado para discutir casos clínicos, actualizar temas y comentar inquietudes relacionadas con la práctica de la Medicina Interna
miércoles, 24 de diciembre de 2014
sábado, 20 de diciembre de 2014
METAHEMOGLOBINEMIA POR DAPSONA EN UNA MUJER DE 39 AÑOS.
 |
| Hospital "Dr Ángel Pintos" de Azul |
Paciente de 39
años que se interna en shock room de
nuestro hospital enviada por su médico cardiólogo por disnea y cianosis.
Su enfermedad
comenzó el día antes de la internación (19/10/2014), con cefalea de tipo
opresiva de baja intensidad y sensación de mareo y embotamiento, cambios de
humor y astenia marcada. La paciente notaba que “estaba lenta” en sus
movimientos lo cual fue confirmado por su madre quien también dice que todos sus
movimientos eran pausados. Al día
siguiente por la mañana (20/10/2014) en su trabajo (maestra de grado), sus
alumnos le hacen notar que tenía un color azulado de piel y mucosas (y que
“parecía Morticia”, de la familia Adams), por lo que decide consultar a un centro
de enfermería donde la encuentran normotensa pero con una frecuencia cardíaca
de 120 por minuto por lo que se le aconseja que vea a su cardiólogo. En la
consulta con el cardiólogo pocos minutos después este constata cianosis
generalizada, taquicardia y taquipnea por lo que la interna.
ANTECEDENTES PATOLÓGICOS:
Obesidad BMI 30.
HTA , colecistectomía por litiasis y psoriasis de larga data. Tabaquismo
intenso de 40 cigarrillos por día desde hace varios años
El día
14/10/2014, es decir 5 días antes de comenzar su enfermedad actual, comienza a tomar dapsona 100 mg/12 horas y
ataraxone 25 mg/día indicados por su
dermatólogo debido a psoriasis.
Al ingreso al
shock room y posteriormente a UTI, la paciente presenta temperatura axilar 36,3°C, TA 160/100 mm Hg, frecuencia cardíaca de 124
por minuto, y frecuencia respiratoria de 24 por minuto.
En el examen
físico no hay signos de insuficiencia cardíaca, no hay soplos, frotes ni
galope, y el examen del aparato respiratorio no reveló anormalidades. El abdomen
era globoso pero indoloro a la palpación superficial y profunda.
Laboratorio de
ingreso Hto 41% GB 8800 Plaquetas 272.000/mm3. Na 141 meq/L, K 3,54. Creatinina 0,70 mg/dl, urea 19
mg/dl. Bilirrubina
0,89, FAL 136 UI/L, TGO 11, TGP 17, DAP TEST negativo. Coagulograma normal. PH
7,43. Gases venosos PO2 34, PCO2 33, HCO3 22, Sat 69%.
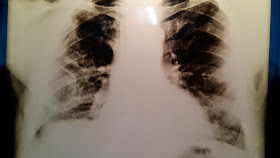
Rx de tórax parece haber una mayor densidad bibasal
que podría corresponder a densidades mamarias, pero sin signos de
redistribución de flujo ni otros signos de insuficiencia cardíaca.
En el ECG se observó taquicardia sinusal, eje a la
derecha y patrón de S1 Q3 T3
Se interpretó el
cuadro inicialmente como tromboembolismo pulmonar y se comenzó anticoagulación
con enoxaparina 80 mg/12 horas.
Se solicitó
dímero D que fue 112 ng/ml (normal hasta 400).
Ecocardiograma
2D: insuficiencia mitral de grado leve, cavidades derechas con diámetro y
función conservadas, cavidades izquierdas con diámetro y función conservadas,
pericardio libre. No se pudo realizar eco Doppler venoso de miembros
inferiores.
TC de tórax con
angio TC: “estudio subóptimo para la evaluación de las arterias pulmonares por
falta de fase arterial pulmonar. Consolidaciones del espacio aéreo basal
bilateral con broncograma aéreo y líquido pleural laminar asociado”
Se descartó
tromboembolismo pulmonar con estos elementos y se comenzó a pensar en
metahemoglobinemia asociada a administración de
Dapsona.
Se solicitó
dosaje de metahemoglobina
Por no tener
disponibilidad de azul de metileno se comenzó con ácido ascórbico (vit C)
Al día siguiente
los gases: PH 7,16, PO2 76,2, PCO2 35,9,
HCO3 12,7, EB -15,9. Sat 91,6%
La PCO2 esperada
es de 27,05 +/- 2= Acidosis metabólica + acidosis respiratoria
Anión GAP 33,3
Delta GAP (13,3)
mayor que delta bicarbonato (11,3) (Acidosis metabólica con GAP alto +
alcalosis metabólica oculta). Por lo tanto no se indica bicarbonato para
corregir acidosis metabólica. Probable sobredosis de ácido ascórbico.
Se recibió
dosaje de metahemoglobina que fue de 16% (Método HPLC). (Valor de referencia
hasta 1%). La muestra fue tomada 3 días después de internada y después de la
administración de ácido ascórbico.
Se solicitan
gases venosos para ver diferencia A-V.
Gases venosos:
PH 7,49, PCO2 36,1, PO2 92, HCO3 27,3 Sat de O2 97,6.
Ionograma: Na 140,
K 3,24, Cl 94.
Diferencia A-V
menos de 5 vol (no se está entregando oxígeno en los tejidos lo que apoya el
diagnóstico de metahemoglobinemia.
CONCLUSIONES DEL CASO
Paciente de 39 años tratada hacía pocos días con una dosis alta de dapsona por psoriasis que presentó síntomas clínicos de metahemoglobinemia y que evolucionó favorablemente con el correr de las horas una vez suspendido el agente agresor. Los niveles de metahemoglobina fueron de 16% por lo que no era estrictamente necesario el uso de azul de metileno como agente reductor. En su lugar se utilizó ácido ascórbico ya que la paciente estaba sintomática.
Digamos que dapsona es un fármaco que produce con frecuencia metahemoglobinemia por lo que hay que estar atentos a su aparición sobre todo los primeros días de tratamiento.
METAHEMOGLOBINEMIAS
INTRODUCCIÓN.
Hay dos tipos de metahemoglobinemias: congénitas y adquiridas.
La metahemoglobinemia
congénita se caracteriza por una incapacidad en la reducción enzimática de la metahemoglobina con lo cual aumenta la hemoglobina
en estado férrico en lugar de volver a
su estado natural funcional que es el estado ferroso. Los pacientes afectados
están cianóticos pero generalmente asintomáticos.
La
metahemoglobinemia adquirida típicamente resulta de la ingestión de fármacos
específicos o agentes que causan un aumento en la producción de
metahemoglobina. Puede ser una enfermedad fatal.
FISIOPATOLOGÍA.
La metahemoglobina es un estado alterado de la hemoglobina en la que el hierro
en estado ferroso (Fe2 +) se oxida al estado
férrico (Fe3 +). Los grupos hemo férricos de metahemoglobina son incapaces de
unirse al oxígeno. Además, se aumenta la afinidad por el oxígeno de los hemos
ferrosos restantes en el tetrámero de hemoglobina (1). Como resultado, la curva
de disociación de oxígeno se "-desplazar a la izquierda" (figura1)
Figura 1. Se ve la curva de disociación de la
oxihemoglobina normal del adulto (hemoglobina A línea sólidas). Se nota que la hemoglobina està saturada al 50%
con una presiòn parcial de oxìgeno de 27 mm Hg (la P50 es 27 mm Hg), y està 100
por ciento saturada a una PaO2 de 100 mm Hg. Se muestra aquì las curvas que
estàn desviadas a la izquierda (lìnea azul que representa un aumento de la
afinidad por el oxìgeno) y desviada a la derecha (línea roja representando
disminución de afinidad por el oxìgeno). El efecto “a la derecha” o “a la
izquierda” de la curva es màs pronunciado a bajas presiones parciales de oxìgeno. En el ejemplo mostrado la curva a la derecha
significa que la hemoglobina puede suministrar aproximadamente 70% de su oxìgeno
unido a una Po2 de 27 mm Hg. En
contraste lacurva a laizquierda puede liberar solo 35% de su oxìgeno unido a
esa Po2.
El efecto neto
es que el paciente con aumento de las concentraciones de metahemoglobina tiene
una anemia funcional mayor de lo que sugieren los datos de laboratorio. Las
moléculas de hemoglobina circulantes que contienen metahemoglobina son
incapaces de transportar oxígeno, y el resto de la oxihemoglobina tiene un
aumento de la afinidad por el oxígeno lo que hace que no se libere en los
tejidos.
FORMACIÓN Y
REDUCCIÓN DE LA METAHEMOGLOBINA.
En individuos normales, la autooxidación de
la hemoglobina a metahemoglobina se produce de forma espontánea a una velocidad
lenta, cada día la conversión es de 0,5 a 3 por ciento de la hemoglobina disponible
para metahemoglobina (2,3). Este autooxidación es contrapesada con la reducción
de metahemoglobina por los mecanismos descritos a continuación, mecanismos que
actúan para mantener un nivel de
metahemoglobina de aproximadamente 1 por ciento de la hemoglobina total en
individuos normales.
Hay dos vías
para la reducción de la metahemoglobina en hemoglobina:
- La vía sólo fisiológicamente importante es la reacción dependiente de NADH catalizada por el citocromo b5 reductasa (B5R).
- Una vía alternativa que no es fisiológicamente activa utiliza NADPH generado por la glucosa-6-fosfato deshidrogenasa (G6PD) en la derivación de la hexosa monofosfato. Sin embargo, normalmente no es portador de electrones presente en las células rojas de la sangre para interactuar con metahemoglobina reductasa NADPH. Receptores de electrones administrados Extrínsecamente, como el azul de metileno (MB) y riboflavina (figura 2) son obligatorias para esta vía para que se active (4). Esta vía se vuelve clínicamente importante para el tratamiento de la metahemoglobinemia.
Figura 2. La vía mayor para la reducción de la
metahemoglobina es la vía de la citocromo b5 reductasa (flecha gruesa). The major pathway for methemoglobin reduction is via
cytochrome b5 reductase (thick arrows). Un
avìa alternative que require un acceptor de electrons exògeno tal como el azul
de metileno es la vìa de la NADPH
metahemoglobina reductasa.
ETIOLOGÍA
CAUSAS
CONGÉNITAS.
La mayoría de los casos de los metahemoglobinemias hereditarias
menos comunes son debido a deficiencia homocigota o heterocigota de
citocromo b5 reductasa 3. Otra causa es la
hemoglobina M
CAUSAS
ADQUIRIDAS.
La mayoría de los casos de metahemoglobinemia son adquiridas y son
el resultado del aumento de la formación de metahemoglobina por diversos
agentes exógenos (tabla 1) (5,8).
Los medicamentos
y anestésicos tópicos - dapsona y agentes anestésicos tópicos (por ejemplo,
benzocaína, lidocaína, prilocaína) parecen ser los agentes precipitantes más
comunes de la metahemoglobinemia adquirida (tabla 1)
DAPSONA. En una
revisión de 138 pacientes con metahemoglobinemia adquirida, el uso de dapsona
representó el 42 por ciento de los casos, con un nivel de metahemoglobina media
de 7,6 por ciento (rango de 2 a 34 por ciento) (9). En un segundo estudio,
metahemoglobinemia se observó en aproximadamente el 20 por ciento de los
pacientes de oncología pediátrica que recibieron dapsona para el tratamiento /
prevención de la infección por Pneumocystis carinii (PCP) (11).
Dado que dapsona sufre recirculación enterohepática,
los niveles sanguíneos de este medicamento puede permanecer elevado durante
algún tiempo. Por consiguiente, los niveles
de metahemoglobina deben seguirse; retratamiento con azul de metileno
puede ser necesario si los niveles de metahemoglobina se mantienen elevados.
AGENTES
ANESTÉSICOS TÓPICOS. Los casos más graves de metahemoglobinemia adquirida se
han visto después del uso de benzocaína al 20 por ciento en pulverización
tópica. A modo de ejemplo, los niveles de metahemoglobina pico medias altas
(media del 32 por ciento) tras la administración benzocaína se observaron en 19
de 28.478 pacientes que fueron sometidos a ecocardiografía transesofágica en
una institución (10). La incidencia de la metahemoglobinemia fue de 0,07 por
ciento. El mecanismo molecular que explica esta asociación no se ha
dilucidado.
ÓXIDO NÍTRICO
INHALADO (NO). El óxido nítrico inhalado (NO) está aprobado para el tratamiento
de niños con hipertensión pulmonar debido a su efecto vasodilatador sobre los
vasos pulmonares. Durante la liberación de unión y de NO a la hemoglobina,
metahemoglobina se forma a una velocidad superior. En un estudio de 81
prematuros y 82 recién nacidos a término, metahemoglobina fue por encima del 5
por ciento en un recién nacido a término, y entre 2,5 y 5 por ciento en 16
lactantes (13).
ANILINA Y SUS
DERIVADOS. Una mujer joven que trabaja en una pintura y tinte de fundición a
presión empleando tintes de anilina se presentó al servicio de urgencias con
cianosis, fiebre y alteración del sensorio y murió de metahemoglobinemia
severa. Mientras que la metahemoglobinemia se atribuyó inicialmente a un
medicamento que estaba tomando (cloroquina), la relación casual a colorante de
anilina no se pudo excluir 14).
Dos jóvenes que
consumieron drogas recreativas desarrollaron metahemoglobinemia severa y el
agente agresor fue identificado por la Administración de Control de Drogas de
Estados Unidos (DEA) y la Food and Drug Administration (FDA) como anilina (15).
Anilina y sus derivados (por ejemplo, tintes de anilina, aminofenol,
fenilhidroxilamina) son compuestos oxidantes altamente tóxicos que se utilizan
en la industria. Además de la ingestión accidental o deliberada, que puedan ser
absorbidos sistémicamente a través de la piel o los pulmones. Tal absorción
puede llevar a concentraciones extremadamente altas de metahemoglobina, que
pueden durar hasta 20 horas después de la exposición y ser relativamente resistentes
al tratamiento con azul de metileno o ácido ascórbico (15). En los casos
graves, resistentes, el tratamiento con oxígeno hiperbárico o exanguinotransfusión
se ha indicado (16).
CLÍNICA
METAHEMOGLOBINEMIA
CONGÉNITA.
La mayoría de
los individuos con concentraciones de metahemoglobina congénitamente , elevadas
son asintomáticos (aunque algunos se quejan de dolor de cabeza y fatiga fácil),
incluso con niveles de metahemoglobina de hasta el 40 por ciento de la
hemoglobina total (17).
La principal
queja de sujetos con metahemoglobinemia congénita es la cianosis, un color azul
pizarra de la piel y mucosas que es
debido al diferente espectro de absorción de metahemoglobina en comparación con
la oxihemoglobina. La cianosis se detecta clínicamente cuando la concentración
absoluta de metahemoglobina supera 1,5 g / dl, equivalente a 8 a 12 por ciento
de metahemoglobina en concentraciones de hemoglobina normales (5,17).
La cianosis se
observa cuando el nivel absoluto de la hemoglobina desoxigenada (hemoglobina
reducida) supera los 4 a 5 g / dl, como en la insuficiencia respiratoria grave
o alteraciones cardíacas debidas a shunts de derecha a izquierda.
Con menos
frecuencia, cianosis está presente cuando los niveles de sulfohemoglobina
superan 0,5 g / dl.
Estos forma de
cianosis no puede ser clínicamente diferenciadas; por lo tanto, se requiere una
prueba de metahemoglobinemia si sospecha.
METAHEMOGLOBINEMIA
ADQUIRIDA.
La metahemoglobinemia adquirida típicamente resulta de la ingestión de
fármacos o agentes específicos (tabla 1) que causan un aumento en la producción
de metahemoglobina, la cual puede ser fatal.
SIGNOS Y
SÍNTOMAS.
Los síntomas en los pacientes con
metahemoglobinemia adquirida son de una dificultad grave en la entrega
de oxígeno a los tejidos lo que no permite tiempo suficiente para que los
mecanismos de compensación tengan lugar.
Los primeros síntomas incluyen dolor de cabeza, fatiga, disnea, y letargo. Con niveles más altos de
metahemoglobina, depresión respiratoria, alteración de la conciencia, shock,
convulsiones y muerte pueden ocurrir (8). La metahemoglobinemia adquirida es
mortal cuando metahemoglobina supera el 30 por ciento de la hemoglobina total.
CIANOSIS DURANTE
LOS PROCEDIMIENTOS ENDOSCÓPICOS. La aparición de cianosis aguda durante los
procedimientos endoscópicos, tales como broncoscopia, puede ser debido a la
obstrucción de las vías respiratorias, pero otra posibilidad es la inducción de
la metahemoglobinemia aguda como resultado del agente anestésico tópico
utilizado antes del procedimiento (por ejemplo, benzocaína, lidocaína, prilocaína)
(24).
Las pistas para
pensar en metahemoglobinemia incluyen el
desarrollo de cianosis en presencia de una PO2 arteria normal y / o la
presencia de "sangre marrón chocolate" en el campo videoscópico (25).
Varias muertes se han atribuido a esta complicación. El reconocimiento rápido,
junto con la infusión inmediata de azul de metileno, puede salvar la vida
delpaciente.
FACTORES DE
RIESGO GENÉTICO SUBYACENTE. Un factor de riesgo de metahemoglobinemia adquirida
aguda es el estado heterocigotos asintomáticos para la deficiencia de citocromo B5R. La descripción
clásica de metahemoglobinemia tóxica aguda en el personal militar de los
Estados Unidos que recibieron profilaxis para malaria en Vietnam demostró por
primera vez que los heterocigotos para esta enfermedad autosómica recesiva pueden,
bajo ciertas condiciones, desarrollar un
estado de enfermedad.
Sin embargo, la
mayoría de las personas que se presentan con metahemoglobinemia aguda adquirida
no son heterocigotos para la deficiencia de citocromo b5 reductasa (27).
DIAGNÓSTICO
SOSPECHA
CLÍNICA. La metahemoglobinemia se puede sospechar clínicamente por la presencia
de "cianosis" con PO2 normal de pO2 (PaO 2) obtenida por gasometría
arterial. La sangre en la metahemoglobinemia ha sido descrito como de color
rojo oscuro, chocolate, o marrón a azul en color, y, a diferencia de la
desoxihemoglobina, el color no cambia con la adición de oxígeno.
OXIMETRÍA DE
PULSO. La oximetría de pulso de rutina puede ser inexacta para el seguimiento
de la saturación de oxígeno en presencia de metahemoglobinemia, y no debe ser
utilizada para hacer el diagnóstico de este trastorno. La presencia de
metahemoglobina se puede sospechar cuando la saturación de oxígeno medida por
oximetría de pulso es significativamente diferente de la saturación de oxígeno
calculado a partir del análisis de gases en sangre arterial ("brecha de
saturación") (9,28,29). Los oxímetros de pulso estándar para determinar la saturación arterial de
oxígeno no son fiables para metahemoglobina y otros derivados de la
hemoglobina.
Los oxímetros de
pulso que utilizan múltiples longitudes de onda para analizar varias
hemoglobinas diferentes se han desarrollado para superar las deficiencias de
los oxímetros de pulso estándar (30).
DIAGNÓSTICO DE
LABORATORIO. El diagnóstico de laboratorio de la metahemoglobinemia se basa en
el análisis de su espectro de absorción, que tiene una absorbancia máxima a 631
nm. Una muestra fresca debe ser obtenida ya que los niveles de metahemoglobina
tienden a aumentar con el almacenamiento de la muestra. El método estándar
dosaje de metahemoglobina utiliza un microprocesador de longitud de onda fija (co-oxímetro). Este
instrumento interpreta todas las lecturas en la zona de 630 nm como
metahemoglobina; por lo tanto, los falsos positivos pueden ocurrir en la
presencia de otros pigmentos incluyendo sulfahemoglobina y azul de metileno
(32,33).
Como resultado,
la metahemoglobina detectada por co-oxímetro debe ser confirmada por el método
Evelyn-Malloy específico (34). Este ensayo implica la adición de cianuro que se
une a la metahemoglobina cargada positivamente, eliminando el pico a 630-635 nm
en proporción directa a la concentración de metahemoglobina. La adición
posterior de ferricianuro convierte todo el espécimen a cianometahemoglobina
para la medición de la concentración total de hemoglobina. La metahemoglobina
se expresa entonces como un porcentaje de la concentración total de
hemoglobina.
El uso del
método Evelyn-Malloy para determinar la concentración de metahemoglobina es
especialmente importante después de la utilización terapéutica de azul de
metileno, ya que el co-oxímetro "lee" azul de metileno como si se
tratara de metahemoglobina.
Sulfahemoglobina,
en concentraciones mayores de 0,5 g / dl también causa "cianosis" con
una PaO2 normal y se puede medir erróneamente como metahemoglobina.
Sulfahemoglobina se puede distinguir de metahemoglobina en virtud de su pico de
absorción a 620 nm, que, a diferencia de metahemoglobina, no es abolida por la
adición de cianuro.
TRATAMIENTO.
El
tratamiento de la metahemoglobinemia depende de la situación clínica (es decir, si la aparición de metahemoglobinemia es aguda, si
es debida a fármacos u otros agentes tóxicos frente y si es una
metahemoglobinemia congénita de toda la vida.
Precauciones
generales - Todos los pacientes con metahemoglobinemia hereditaria deben evitar
la exposición a derivados de anilina, nitratos y otros agentes que pueden,
incluso en individuos normales, inducir metahemoglobinemia (tabla). Los heterocigotos
conocidos de deficiencia B5R citocromo deben ser asesoradas de manera similar.
En la
metahemoglobinemia adquirida, los agentes ofensivos en metahemoglobinemia
adquirida debe interrumpirse (tabla 1).
- En grados menores
de metahemoglobinemia (es decir, un paciente asintomático con un nivel de
metahemoglobina de menos de 20 por
ciento) puede no ser necesaria ninguna terapia que no sea la suspensión del
agente agresor.
- Si el paciente está sintomático o si el nivel de metahemoglobina es mayor de 20 por ciento, que es a menudo el caso en las sobredosis deliberada o accidental o ingestión de toxinas, la terapia específica con azul de metileno se indica.
- La transfusión de sangre o la exanguinotransfusión puede ser útil en pacientes que están en estado de shock. El oxígeno hiperbárico se ha utilizado con éxito anecdótico en los casos graves (50).
USO AGUDO DE
AZUL DE METILENO. La metahemoglobinemia
adquirida es potencialmente mortal cuando metahemoglobina es mayor de 30 por ciento de la hemoglobina total. Aunque
no existe de ningún estudio sistemático que compare el uso de azul de metileno
con otros agentes o con placebo, el uso de azul de metileno se considera el
tratamiento de elección.
Administrado por
vía intravenosa en una dosis de 1 a 2 mg / kg durante cinco minutos,
proporciona un transportador de electrones artificial para la reducción final
de la metahemoglobina través de la vía dependiente de NADPH (figura 2) (5,1)
La respuesta
suele ser rápida; la dosis se puede repetir en una hora si el nivel de
metahemoglobina es todavía alto una hora después de la infusión inicial, pero
el retratamiento con frecuencia no es necesario.
Sin embargo, la metahemoglobinemia de rebote puede ocurrir
hasta 18 horas después de la administración azul de metileno, 60 por ciento son
debidos a la absorción prolongada del agente implicado en sitios tópicos o
entéricos (29). En consecuencia, es razonable realizar mediciones seriadas de
los niveles de metahemoglobina después del tratamiento con AM con el fin de
evaluar al paciente por empeoramiento posterior.
TOXICIDAD. Se
debe tener precaución para evitar la sobredosificación, como grandes (mayores
de 7 mg / kg) o las dosis acumuladas de
AM puede provocar disnea y dolor en el pecho, así como la hemólisis en algunos
sujetos susceptibles (51,52). Dado que la co-oximetría detecta AM como
metahemoglobina, esta técnica no se puede utilizar para seguir la respuesta de
los niveles de metahemoglobina a tratamiento con MB. Si fuera necesario, el
método específico Evelyn-Malloy discriminará entre metahemoglobina y AM.
AM es un potente
inhibidor reversible de la monoaminooxidasa A, una enzima responsable de
descomponer la serotonina en el cerebro. Su uso en pacientes que toman medicamentos
psiquiátricos serotoninérgicos puede resultar en altos niveles de serotonina
del cerebro (es decir, el síndrome de la serotonina) y debe evitarse siempre
que sea posible (53).
METAHEMOGLOBINEMIA
INDUCIDA DAPSONA.
Marcada metahemoglobinemia puede ocurrir después del
tratamiento de la dermatitis herpetiforme o infección por Pneumocystis (PCP)
con dapsona.
La cimetidina,
utilizada como un inhibidor selectivo de N-hidroxilación, puede ser eficaz en
el aumento de la tolerancia del paciente a la dapsona, bajando el nivel de
metahemoglobina crónicamente en más de un 25 por ciento (54,55). Dado que
funciona lentamente, cimetidina no es útil para la gestión de la
metahemoglobinemia sintomática aguda provocadas por el uso de dapsona.
PACIENTES CON DEFICIENCIA
DE G6PD. No se les debe
administrar AM a pacientes con deficiencia conocida de glucosa 6-fosfato
deshidrogenasa (G6PD), ya que la reducción de la metahemoglobina por AM es
dependiente de NADPH generado por G6PD (figura 2). Como resultado, AM no sólo
pueden ser ineficaz, sino que también es potencialmente peligroso, ya que tiene
un potencial oxidante que puede inducir hemólisis en sujetos con deficiencia de
G6PD (56).
Fuente UpToDate
REFERENCES
Darling R, Roughton
F. The effect of methemoglobin on the equilibrium between oxygen and
hemoglobin. Am J Physiol 1942; 137:56.
Eder HA, Finch
C, McKee RW. CONGENITAL METHEMOGLOBINEMIA. A CLINICAL AND BIOCHEMICAL STUDY OF
A CASE. J Clin Invest 1949; 28:265.
JAFFE ER, NEURMANN
G. A COMPARISION OF THE EFFECT OF MENADIONE, METHYLENE BLUE AND ASCORBIC ACID
ON THE REDUCTION OF METHEMOGLOBIN IN VIVO. Nature 1964; 202:607.
Yubisui T,
Takeshita M, Yoneyama Y. Reduction of methemoglobin through flavin at the
physiological concentration by NADPH-flavin reductase of human erythrocytes. J
Biochem 1980; 87:1715.
Agarwal N, Nagel
RL, Prchal JT. Dyshemoglobinemias. In: Disorders of Hemoglobin: Genetics,
Pathophysiology, and Clinical Management, 2nd ed, Steinberg M (Ed), 2009.
p.607.
Hegesh E, Hegesh
J, Kaftory A. Congenital methemoglobinemia with a deficiency of cytochrome b5.
N Engl J Med 1986; 314:757.
Congenital
methemoglobinemia with cytochrome b5 deficiency. N Engl J Med 1986; 315:893.
Coleman MD,
Coleman NA. Drug-induced methaemoglobinaemia. Treatment issues. Drug Saf 1996;
14:394.
Ash-Bernal R,
Wise R, Wright SM. Acquired methemoglobinemia: a retrospective series of 138
cases at 2 teaching hospitals. Medicine (Baltimore) 2004; 83:265.
Kane GC, Hoehn
SM, Behrenbeck TR, Mulvagh SL. Benzocaine-induced methemoglobinemia based on
the Mayo Clinic experience from 28 478 transesophageal echocardiograms:
incidence, outcomes, and predisposing factors. Arch Intern Med 2007; 167:1977.
Esbenshade AJ,
Ho RH, Shintani A, et al. Dapsone-induced methemoglobinemia: a dose-related
occurrence? Cancer 2011; 117:3485.
Hall NM, Jones
FJ, Ainsworth CR, Fincher RK. Methemoglobinemia in patients undergoing
esophagogastroduodenoscopy: a randomized controlled trial. Mil Med 2013;
178:701.
Hamon I,
Gauthier-Moulinier H, Grelet-Dessioux E, et al. Methaemoglobinaemia risk
factors with inhaled nitric oxide therapy in newborn infants. Acta Paediatr
2010; 99:1467.
Sankar J, Gupta
A, Pathak S, Dubey NK. Death in an adolescent girl with methemoglobinemia and
malaria. J Trop Pediatr 2012; 58:154.
Kusin S, Tesar
J, Hatten B, et al. Severe methemoglobinemia and hemolytic anemia from aniline
purchased as 2C-E (4-ethyl-2,5-dimethoxyphenethylamine), a recreational drug,
on the Internet - Oregon, 2011. MMWR Morb Mortal Wkly Rep 2012; 61:85.
Management
guidelines for aniline exposure.
http://www.atsdr.cdc.gov/mmg/mmg.asp?id=448&tid=79 (Accessed on February
23, 2012).
Jaffe E.
Hereditary methemoglobinemias associated with abnormalities in the metabolism
of erythrocytes. Am J Med 1962; 32:512.
Leroux A, Junien
C, Kaplan J, Bamberger J. Generalised deficiency of cytochrome b5 reductase in
congenital methaemoglobinaemia with mental retardation. Nature 1975; 258:619.
Ewenczyk C,
Leroux A, Roubergue A, et al. Recessive hereditary methaemoglobinaemia, type
II: delineation of the clinical spectrum. Brain 2008; 131:760.
Takeshita M,
Tamura M, Kugi M, et al. Decrease of palmitoyl-CoA elongation in platelets and
leukocytes in the patient of hereditary methemoglobinemia associated with
mental retardation. Biochem Biophys Res Commun 1987; 148:384.
Takeshita M,
Tamura M, Yoshida S, Yubisui T. Palmitoyl-CoA elongation in brain microsomes:
dependence on cytochrome b5 and NADH-cytochrome b5 reductase. J Neurochem 1985;
45:1390.
Junien C, Leroux
A, Lostanlen D, et al. Prenatal diagnosis of congenital enzymopenic
methaemoglobinaemia with mental retardation due to generalized cytochrome b5
reductase deficiency: first report of two cases. Prenat Diagn 1981; 1:17.
Kaftory A,
Freundlich E, Manaster J, et al. Prenatal diagnosis of congenital
methemoglobinemia with mental retardation. Isr J Med Sci 1986; 22:837.
US FDA
benzocaine warning.
http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm250264.htm
(Accessed on March 13, 2014).
Henry LR,
Pizzini M, Delarso B, Ridge JA. Methemoglobinemia: early intraoperative
detection by clinical observation. Laryngoscope 2004; 114:2025.
Cohen RJ, Sachs
JR, Wicker DJ, Conrad ME. Methemoglobinemia provoked by malarial
chemoprophylaxis in Vietnam. N
Engl J Med 1968; 279:1127.
Maran J, Guan Y,
Ou CN, Prchal JT. Heterogeneity
of the molecular biology of methemoglobinemia: a study of eight consecutive
patients. Haematologica 2005; 90:687.
Barker SJ,
Tremper KK, Hyatt J. Effects of methemoglobinemia on pulse oximetry and mixed
venous oximetry. Anesthesiology 1989; 70:112.
Guay J.
Methemoglobinemia related to local anesthetics: a summary of 242 episodes.
Anesth Analg 2009; 108:837.
Barker SJ, Curry
J, Redford D, Morgan S. Measurement of carboxyhemoglobin and methemoglobin by
pulse oximetry: a human volunteer study. Anesthesiology 2006; 105:892.
Feiner JR,
Bickler PE, Mannheimer PD. Accuracy of methemoglobin detection by pulse
CO-oximetry during hypoxia. Anesth Analg 2010; 111:143.
Kelner MJ,
Bailey DN. Mismeasurement of methemoglobin ("methemoglobin
revisited"). Clin Chem 1985; 31:168.
Molthrop DC Jr,
Wheeler RH, Hall KM, Prchal JT. Evaluation of the methemoglobinemia associated
with sulofenur. Invest New Drugs 1994; 12:99.
Evelyn K, Malloy
H. Microdetermination of oxyhemoglobin, methemoglobin, and sulfhemoglobin in a
single sample of blood. J Biol Chem 1938; 126:655.
Jaffé ER.
Hereditary methemoglobinemias associated with abnormalities in the metabolism
of erythrocytes. Am J Med 1966; 41:786.
Jaffe ER, Hsieh
HS. DPNH-methemoglobin reductase deficiency and hereditary methemoglobinemia.
Semin Hematol 1971; 8:417.
BEUTLER E,
BALUDA MC. METHEMOGLOBIN REDUCTION. STUDIES OF THE INTERACTION BETWEEN CELL
POPULATIONS AND OF THE ROLE OF METHYLENE BLUE. Blood 1963; 22:323.
Board PG,
Pidcock ME. Methaemoglobinaemia resulting from heterozygosity for two
NADH-methaemoglobin reductase variants: characterization as NADH-ferricyanide
reductase. Br J Haematol
1981; 47:361.
González R,
Estrada M, Wade M, et al. Heterogeneity
of hereditary methaemoglobinaemia: a study of 4 Cuban families with
NADH-Methaemoglobin reductase deficiency including a new variant (Santiago de
Cuba variant). Scand J Haematol 1978; 20:385.
Hegesh E,
Calmanovici N, Avron M. New method for determining ferrihemoglobin reductase
(NADH-methemoglobin reductase) in erythrocytes. J Lab Clin Med 1968; 72:339.
Prchal JT,
Borgese N, Moore MR, et al. Congenital methemoglobinemia due to methemoglobin
reductase deficiency in two unrelated American black families. Am J Med 1990;
89:516.
Vieira LM,
Kaplan JC, Kahn A, Leroux A. Four new mutations in the NADH-cytochrome b5
reductase gene from patients with recessive congenital methemoglobinemia type
II. Blood 1995; 85:2254.
Jaffe ER,
Hultquist DE. Cytochrome b5 reductase deficiency and enzymopenic hereditary
methemoglobinemia. In: The Metabolic and Molecular Bases of Inherited Disease,
7th ed, Scriver CR, Beaudet AL, Sly WS, Valle D (Eds), McGraw-Hill, New York
1995. p.3399.
Shirabe K, Landi
MT, Takeshita M, et al. A novel point mutation in a 3' splice site of the
NADH-cytochrome b5 reductase gene results in immunologically undetectable
enzyme and impaired NADH-dependent ascorbate regeneration in cultured
fibroblasts of a patient with type II hereditary methemoglobinemia. Am J Hum
Genet 1995; 57:302.
Yubisui T,
Naitoh Y, Zenno S, et al. Molecular cloning of cDNAs of human liver and
placenta NADH-cytochrome b5 reductase. Proc Natl Acad Sci U S A 1987; 84:3609.
Board PG.
NADH-ferricyanide reductase, a convenient approach to the evaluation of
NADH-methaemoglobin reductase in human erythrocytes. Clin Chim Acta 1981;
109:233.
Jenkins MM,
Prchal JT. A novel mutation found in the 3' domain of NADH-cytochrome B5
reductase in an African-American family with type I congenital
methemoglobinemia. Blood 1996; 87:2993.
Beutler E.
Methemoglobinemia and other causes of cyanosis. In: Williams' Hematology, 5th
ed, Beutler E, Lichtman MA, Coller B, Kipps TJ (Eds), McGraw-Hill, New York
1995. p.654.
Kaplan JC,
Chirouze M. Therapy of recessive congenital methaemoglobinaemia by oral
riboflavine. Lancet 1978; 2:1043.
Goldstein GM,
Doull J. Treatment of nitrite-induced methemoglobinemia with hyperbaric oxygen.
Proc Soc Exp Biol Med 1971; 138:137.
GOLUBOFF N,
WHEATON R. Methylene blue induced cyanosis and acute hemolytic anemia
complicating the treatment of methemoglobinemia. J Pediatr 1961; 58:86.
Harvey JW, Keitt
AS. Studies of the efficacy and potential hazards of methylene blue therapy in
aniline-induced methaemoglobinaemia. Br J Haematol 1983; 54:29.
MedWatch Safety
Alert.
http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm265476.htm
(Accessed on March 13, 2014).
Coleman MD,
Rhodes LE, Scott AK, et al. The use of cimetidine to reduce dapsone-dependent
methaemoglobinaemia in dermatitis herpetiformis patients. Br J Clin Pharmacol
1992; 34:244.
Coleman MD.
Dapsone: modes of action, toxicity and possible strategies for increasing
patient tolerance. Br J Dermatol 1993; 129:507.
Rosen PJ, Johnson
C, McGehee WG, Beutler E. Failure of methylene blue treatment in toxic
methemoglobinemia. Association with glucose-6-phosphate dehydrogenase
deficiency. Ann Intern Med 1971; 75:83.
Vichinsky EP,
Lubin BH. Unstable hemoglobins, hemoglobins with altered oxygen affinity, and
m-hemoglobins. Pediatr
Clin North Am 1980; 27:421.
domingo, 14 de diciembre de 2014
MESOTELIOMA PERITONEAL MALIGNO EN VARÓN DE 83 AÑOS
Paciente
masculino de 83 años.
MOTIVO DE INTERNACIÓN: ascitis
ENFERMEDAD ACTUAL: Hace tres
meses el paciente comienza con
sintomatología abdominal alta, inespecífica, dolorosa especialmente localizada en epigastrio y
saciedad precoz, por lo que se solicita una ecografía abdominal que muestra una
masa compatible con tumor más probablemente pancreático. Se solicitó una TC de tórax, abdomen y pelvis para el estudio
de la misma. Dado la masa vista en la TC
se comenzaron estudios tendientes a localizar el órgano de asentamiento de tal
masa siendo todos los estudios negativos incluyendo una fibroendoscopía
digestiva alta y fibrocolonoscopía. En
ecografías posteriores también se descartó al páncreas como órgano involucrado
en el origen de la tumoración. Se programó una laparoscopía diagnóstica pero en
ese contexto, hace dos meses comenzó a presentar compromiso severo de su estado general que había sido casi normal
hasta entonces, acompañado de distensión abdominal la cual fue progresiva en forma
ininterrumpida hasta la fecha.
Hace un mes se agrega dolor en miembro inferior
izquierdo y síndrome de repercusión general. El paciente ha adelgazado a pesar
del cuadro de distensión abdominal que impresionó al ingreso como ascitis. El
dolor lumbar irradiado a miembro inferior izquierdo se lo interpretó como
secundario a discopatías crónicas múltiples en el contexto de estenosis espinal
ya estudiados en el pasado reciente con RMN.
TOMOGRAFÍA DE 2
MESES ANTES DE LA INTERNACIÓN
ANTECEDENTES
PATOLÓGICOS: tabaquismo de entre 10 y 20 cigarrillos /día desde hace más
de 50 años. Diabetes tipo2 tratada con
Glemaz y Euglucon. Trabajó durante más de 20 años en una fábrica de fibras de
poliéster donde estuvo fuertemente expuesto al asbesto. Muchos compañeros de
trabajo de esa época actualmente padecen asbestosis y mesoteliomas pleurales.
EXAMEN FÍSICO:
lúcido, afebril, hemodinámicamente estable, TA 110/60 mm Hg, frecuencia
cardíaca 95 por minuto. Eupneico. Saturación digital 97%. Soplo sistólico
eyectivo aórtico grado 3/6.
Abdomen
distendido, percutoriamente matidez desplazable compatible con ascitis libre.
Edema en
miembros inferiores y sacro 1+
Dolor a la
movilidad pasiva de miembro inferior izquierdo. Lumbociatlagia izquierda con
Lasegue positivo.
LABORATORIO
09/11/2014: GR: 3.050.000 Hto 25% Hb 8,7 g/dlGB: 32.100 (Neutrófilos 87%,
Linfocitos 10%, Monocitos 3%). Plaquetas 413.000. Urea 185 mg/dl, creatinina
3,77 mg/dl. Na 134 meq/l, K 5.3 meq/l. Cl 98 meq/l.
Diez días antes
(30/10/2014): urea: 73 mg/dl. Creatinina:
1.2 mg/dl. LDH 615UI/L
Una Rx de tórax mostró calcificaciones pleurales
difusas que también involucraban la pleura diafragmática compatible con
asbestosis.
Líquido ascítico: color Amarillo. Aspecto
ligeramente turbio. Ph 7,5. Hb contiene +. Glucosa 146mg/dl. Proteínas 2,8
g/dl. Albúmina 2,1 g/dl. Leucocitos: abundante cantidad. Piocitos 2 a 3 por
campo. GASA:0,9.
Después de la paracentesis comenzó a palparse una
tumoración centroabdominal dura que despierta dolor y que parece estar fija a
los tejidos abdominales profundos.
Se comenzó tratamiento como peritonitis bacteriana
espontánea con ceftriaxona 1 gr/12 horas.
Se realizó una ecografía abdominal (ver informes)
Los cultivos fueron negativos
Se realiza una
segunda paracentesis que mostró un
cambio en la citología que en la primera había sido a predominio neutrofílico y
la segunda mostró un franco predominio linfocitario.
No se observaron
células neoplásicas
El paciente
evolucionó con un rápido deterioro de su estado general con ascitis de rápida
reproducción e insuficiencia renal con valores nitrogenados crecientes y
oligoanuria.
Dado su
condición clínica severamente deteriorada los familiares decidieron suspender
medidas de sostén aprobando solo medidas que brinden confort al paciente.
Se produce óbito
CONCLUSIONES DEL
CASO
Lamentablemente
este paciente de 83 años no dio tiempo a determinar la causa de su enfermedad a
todas luces neoplásica y de evolución sumamente agresiva. La presencia de una
masa abdominal de densidad de partes blandas seguida de ascitis de rápida
reproducción, severo cuadro de repercusión general, sumado a la ausencia de
enfermedad infecciosa, inflamatoria o inmunológica por los estudios
diagnósticos, con ininterrumpida evolución al óbito en un plazo corto hacen
tener la firme presunción de que se trataba de una enfermedad neoplásica
agresiva. El antecedente de fuerte exposición a asbesto varias décadas atrás, la aparición de
neoplasias relacionadas con asbesto como mesoteliomas pleurales en varios compañeros de trabajo, la presencia de severa calcificación pleural
bilateral con afectación de pleura diafragmática, y la presencia de una masa abdominal seguida
de la aparición de ascitis nos hacen suponer con alto grado de probabilidad que
se trataba de un mesotelioma peritoneal maligno.
No se solicitó
autopsia.
MESOTELIOMA
PERITONEAL MALIGNO:
INTRODUCCIÓN
El mesotelioma maligno es un tumor maligno
altamente letal de las membranas serosas de la pleura, peritoneo, pericardio, o
túnica vaginal de los testículos. Esta es una rara enfermedad. A modo de
ejemplo, de los aproximadamente 3.300 casos de mesotelioma diagnosticados en
Estados Unidos cada año, sólo el 10 a 15 por ciento son peritoneales 1-4. El
peritoneo es el segundo sitio más frecuente de origen de mesotelioma, después
de la pleura. La patogénesis de todas las formas de mesotelioma está
fuertemente asociado con los contaminantes industriales, de los que el amianto
es el cancerígeno principal asociado con la enfermedad.
El mesotelioma
peritoneal maligno (MPM) es una enfermedad poco estudiada, en gran parte porque
la mayoría de los estudios moleculares y clínicos se han llevado a cabo
predominantemente en pacientes con la variante más común que es la pleural. Sin
embargo, no está claro que las dos enfermedades sean similares. Mientras que
comparten el mismo factor de riesgo predominante (la exposición al amianto),
los perfiles de expresión de genes de mesoteliomas pleurales y peritoneales son
distintos, lo que sugiere diferencias en la patogénesis molecular entre los dos
5,6.
EPIDEMIOLOGÍA Y
FACTORES DE RIESGO
El mesotelioma
peritoneal maligno (MPM) representa alrededor del 10 al 15 por ciento de todos
los casos de mesotelioma, y hay alrededor de 400 casos nuevos diagnosticados
cada año en EE UU 1,2. Las tasas de mesotelioma están aumentando en todo el
mundo, en gran parte un reflejo de la exposición al amianto en el trabajo
1,4,7,8. Se espera su punto máximo entre 2015 y 2025. Sin embargo, el
mesotelioma pleural más que el peritoneal representa la mayor parte del aumento
del número de casos. Por lo menos en los EE.UU., las tasas de incidencia de MPM
se han mantenido estables durante los últimos 30 años4,9.
En contraste con
el mesotelioma pleural, que tiene un
predominio masculino (relación hombre-mujer de entre cuatro y cinco a uno), los
hombres comprenden una menor proporción de casos de MPM 1,2,4,10.
La edad media de
presentación es de 53 años, más joven que la del paciente promedio con
mesotelioma pleural 4,12. Aunque MPM es típicamente una enfermedad de los
adultos, se han reportado casos de la infancia 13-15.
FACTORES DE
RIESGO
Asbesto
Existe una fuerte
relación entre la exposición al amianto y el desarrollo de mesotelioma en
cualquier ubicación. El riesgo de por vida de desarrollar mesotelioma entre los
trabajadores del asbesto se piensa que es tan alto como el 10 por ciento, y el
período de latencia entre la exposición y el desarrollo de mesotelioma es de
aproximadamente 30 años.
La relación
entre la exposición al amianto y MPM es menos fuerte de lo que es para el
mesotelioma pleural, especialmente entre las mujeres 11,16-18.
Sin embargo, el
asbesto es el mejor factor de riesgo definido para MPM.
El tipo de fibra
principal implicado en los EE.UU. es amosita (un anfíbol); en contraste con
mesotelioma pleural, el crisotilo no ha demostrado causar MPM 3.
Radioterapia
A pesar de que
la exposición al amianto es el factor de riesgo predominante definido, también
hay informes de casos de MPM que surgen en los campos irradiados, aunque el
número es pequeño en general y la magnitud del riesgo no está definido 25-27.
Debido al bajo número de casos reportados, los estudios epidemiológicos a gran
escala sobre la relación entre la irradiación previa y mesotelioma peritoneal
no ha sido posible.
Otros factores
La exposición a
otras fibras minerales (por ejemplo, erionita, una fibra de silicato, de la
familia de zeolita) se reporta como un factor de riesgo para peritoneal, así como
el mesotelioma pleural 28.
Un gran número
de mesoteliomas pleurales contiene secuencias de la papovavirus, virus de simio
40 (SV40), y esto se ha visto en el mesotelioma peritoneal también.
PRESENTACIÓN E
IMÁGENES.
No hay signos o síntomas específicos para el mesotelioma peritoneal
maligno (MPM). Aunque la mayoría de los casos son sintomáticos, algunos son
diagnosticados por cierto, después de la investigación en un proceso no
relacionado, como la infertilidad, o reconocido durante un examen físico de
rutina 37-39.
La mayoría de
los casos de MPM se presenta con
compromiso peritoneal difuso y se lo conoce como mesotelioma peritoneal difuso,
mesotelioma peritoneal maligno o simplemente
mesotelioma peritoneal. Sin embargo, una minoría de los casos tiene
enfermedad localizada. 40,41
El MPM es altamente agresivo, con algunas
excepciones (como los mesoteliomas papilares bien diferenciados que se producen
en las mujeres)
En cambio, los
pacientes con un MPM localizado por lo general tienen un buen pronóstico
después de la extirpación quirúrgica completa.
CARACTERÍSTICAS
CLÍNICAS
Mesotelioma
difuso versus localizado:
Las
manifestaciones clínicas de MPM difuso están relacionados con la ascitis o la
progresión del tumor dentro de la cavidad abdominal 42,43. Las quejas más
comunes incluyen distensión abdominal y / o el aumento de la circunferencia
abdominal, dolor o malestar abdominal, náuseas, anorexia y pérdida de peso. Las
complicaciones gastrointestinales tales como la obstrucción intestinal son
generalmente una manifestación de la enfermedad avanzada.
Debido a la
naturaleza inespecífica de los síntomas de presentación, muchos pacientes ya
tienen una carga de enfermedad avanzada
al momento del diagnóstico. Una minoría de los pacientes son asintomáticos y se
diagnostican a menudo como masa
abdominal palpable 38,39.
Distensión
abdominal (aumento de la circunferencia abdominal), el síntoma inicial más
frecuente, está presente en 30 a 80 por ciento de los pacientes. Puede causar
saciedad precoz, disfagia, y falta de aire, todo lo cual contribuye a la
pérdida de peso, el estado funcional deficiente, e inanición total. Distensión
abdominal también puede manifestarse como una aparición o empeoramiento de
hernia de la pared abdominal.
La mayoría de
los pacientes con distensión abdominal debido a exceso de alimentación o que desarrollan progresiva acumulación de
ascitis asociada a condiciones no malignas (por ejemplo, cirrosis), aumentan de
peso. La disminución de peso asociado con la pérdida de la masa corporal magra
en un paciente con aumento progresivo del perímetro abdominal debe plantear la
sospecha de ascitis maligna secundaria a un tumor maligno peritoneal.
El dolor es el
segundo síntoma inicial más común y está presente en el diagnóstico en el 27 a
58 por ciento de los pacientes 38,44-46. En la mayoría de los casos, el dolor
es difuso y no específico, aunque una pequeña minoría se presenta con un
abdomen agudo secundario a perforación u obstrucción 47.
La forma
localizada, menos común de MPM presenta como una masa circunscrita focal que
pueden invadir localmente y extenderse a órganos adyacentes, pero por lo
general no se propaga de forma difusa en toda la cavidad peritoneal 40,41. Los
pacientes pueden quejarse de dolor abdominal localizado o tener una masa abdominal
o pélvica palpable 40.
Patrón de
diseminación
La morbilidad y
la mortalidad por MPM son casi invariablemente debido a la progresión de la
enfermedad dentro de la cavidad peritoneal. Sin embargo, MPM también puede
extenderse a la cavidad pleural durante las últimas etapas de progresión de la
enfermedad, causando un derrame pleural.
Con poca
frecuencia, MPM hace metástasis a los ganglios linfáticos abdominales y
pélvicos. Metástasis en los ganglios linfáticos se encuentran en
aproximadamente 20 a 28 por ciento de los pacientes sometidos a cirugía
citorreductora.
Las metástasis a
distancia son muy poco frecuentes 50-54.
Fenómenos
paraneoplásicos.
Un número de
fenómenos paraneoplásicos se han descrito en el contexto de mesotelioma,
incluyendo 55-59:
Fiebre
Trombocitosis
Trombosis
relacionada con malignidad
Hipoglucemia
En raras
ocasiones la anemia hemolítica, Coombs positiva
IMÁGENES
RADIOLÓGICAS
Mesotelioma
difuso
La tomografía
computarizada (TC) es el estudio diagnóstico inicial más útil y por lo general
es la primera prueba ordenada en un paciente con dolor abdominal y aumento de la circunferencia abdominal. Las
masas peritoneales y nódulos pueden mejorar en la TC después de la inyección
intravenosa de material de contraste yodado. Sin embargo, la TC, al igual que con
otras modalidades de imagen, tiende a subestimar la carga real de la
enfermedad. La tomografía por Emisión de Positrones (PET) se ha utilizado para
la estadificación, pero no es fiable para evaluar la extensión de la enfermedad
en MPM 60.
Los patrones y
características de MPM de imagen se muestran igualmente bien en imágenes de
resonancia magnética (MRI). Informes describen la intensidad de la señal de MPM
como intermedia a baja en las imágenes ponderadas en T1 e intermedia a alta en
T2 imágenes 61. Más recientemente, con
ponderación de difusión y dinámica se ha demostrado en la MRI con gadolinio es
más específica para precisar la masa total de enfermedad.
Además del tumor
primario, de moderada a extensa (rara vez masiva) ascitis está presente en el 60
al 100 por ciento de los pacientes de nuevo diagnóstico 44,64.
Las
calcificaciones dentro MPM difusa se consideran raras. Placas calcificadas se
ven con menos frecuencia que con mesotelioma pleural; Sin embargo, las placas
pleurales calcificadas y otros signos asociados con la exposición al asbesto
pueden estar presentes en el tórax de estos pacientes hasta en el 50 por ciento 68.
Mesotelioma
localizado.
El mesotelioma
localizado es una manifestación poco común de la enfermedad. El tipo localizada
de MPM se presenta como una masa intraperitoneal heterogénea, sólida en las
imágenes de la sección transversal. Los márgenes suelen ser irregulares, y
puede haber festoneado o invasión directa de las estructuras viscerales
adyacentes tales como el hígado, el bazo o los órganos pélvicos. Localizada,
líquido ascítico loculado puede estar presente, pero las manifestaciones de
afectación difusa peritoneal (ascitis generalizada, apelmazamiento de epiplón,
y nodularidad peritoneal) están ausente 63.
DIAGNÓSTICO DIFERENCIAL
Con base en los
hallazgos de imagen, el diagnóstico diferencial de un MPM típico difusa incluye
carcinomatosis peritoneal, carcinoma peritoneal seroso, el carcinoma de ovario
en las mujeres, linfomatosis, y peritonitis tuberculosa. No hay características
de imagen que son específicas para el MPM 44, aunque algunas características
pueden ayudar a sugerir un diagnóstico específico:
Las metástasis
hepáticas y adenopatías son más comunes con carcinomatosis peritoneal de los
tumores primarios del tracto gastrointestinal de lo que son con MPM 65.
El hallazgo de
adenopatías difusas con la falta de participación de epiplón debe plantear la
sospecha de linfoma.
Peritonitis
tuberculosa generalmente se caracteriza por el engrosamiento peritoneal,
adenopatías mesentéricas con necrosis central, ascitis con una alta atenuación,
y esplenomegalia.
En las mujeres,
el diferencial principal es difusa entre MPM y el carcinoma seroso del
peritoneo 69. Esta entidad es una neoplasia primaria se plantee dentro del
peritoneo, pero no es probable de origen de células mesoteliales. En lugar de
ello, se considera que surgen de restos epiteliales de ovario que son un
remanente del descenso del ovario en la pelvis. Cualquiera de los anexos de la
pelvis puede, de hecho, ser una fuente de estas células. Estos tumores son
histológicamente, inmunofenotípicamente, y clínicamente distinta de
mesotelioma, pero similar a carcinomas epiteliales del ovario.
Dos tumores
malignos primarios del peritoneo relacionados con características distintivas
en la TC son el mesotelioma papilar bien diferenciado, y el mesotelioma
multiquístico. Estos tumores son importantes para distinguir de mesotelioma
peritoneal difuso debido a que su estrategia de tratamiento es principalmente
quirúrgico y la evolución clínica es en gran parte benigno.
HALLAZGOS DE
LABORATORIO.
La bioquímica
sérica y los marcadores tumorales no tienen ningún valor en el establecimiento
de un diagnóstico de MPM. Los niveles elevados de hialuronano, CA-125, alfa
fetoproteína, antígeno carcinoembrionario, y la mesotelina se encuentran en
algunos pacientes, y con frecuencia hay una correlación entre los niveles
elevados y progresión de la enfermedad. Sin embargo, para propósitos de
diagnóstico, la especificidad de todos estos marcadores tumorales es baja 44,70.
Algunos de estos
marcadores (particularmente CA-125 70 y la mesotelina) puede resultar útil para
seguir la respuesta a la terapia o para la vigilancia después del tratamiento,
si se elevan inicialmente.
La mesotelina y
el péptido relacionado con la mesotelina soluble - La mesotelina es una
glucoproteína que se expresa en la superficie de las células mesoteliales
normales y altamente sobreexpresado en el mesotelioma maligno. Péptidos
relacionados con la mesotelina soluble
se cree que son o bien fragmentos de péptido escindido de mesotelina, o
variantes anormales de mesotelina que no son capaces de unirse a las membranas
y se encuentran en el suero. La mesotelina y sus fragmentos peptídicos
asociados parecen ser de algún valor como marcadores tumorales en el
mesotelioma, aunque limitado a la epitelioide y subtipos bifásicos. La mayor
parte de los datos se encuentran en los pacientes con la variante pleural.
DIAGNÓSTICO E
HISTOLOGÍA
El diagnóstico
de mesotelioma peritoneal debe ser considerados en cualquier individuo con la
evidencia de un proceso maligno difuso en el abdomen en la evaluación clínica y
radiográfica inicial, y por lo general se pueden establecer con citología o biopsia.
En general, el
análisis citológico del líquido ascítico es de utilidad diagnóstica limitada.
La citología del líquido es a menudo poco concluyente y tiene un bajo
rendimiento 45,58. La diferenciación entre causas benignas o malignas de la
proliferación de células mesoteliales puede ser especialmente difícil. La
citología no permite la evaluación de la verdadera invasión del estroma en el
peritoneo o las vísceras subyacentes, el parámetro que define de malignidad es
la invasión.
La biopsia con
aguja gruesa guiada por TC o biopsia laparoscópica pueden proporcionar tanto
material suficiente para hacer un diagnóstico del tejido. Características visto
en hematoxilina y eosina teñidas
secciones y características de tinción inmunohistoquímica suele permitir la
diferenciación de mesotelioma de otros tumores. Debido a la propensión a las
siembras de mesotelioma en el trayecto
de la aguja o de los sitios de punción con trocar.
HISTOLOGÍA
Macroscópicamente, MPM se caracteriza
macroscópicamente por cientos de miles de nódulos tumorales individuales de
diferente tamaño y consistencia que suelen estar difusamente diseminados por
toda la cavidad peritoneal (imagen 1). Las lesiones pueden variar desde difusas
subcentimétricos grises nódulos duros a grandes masas nodulares que se propagan
en las hojas y se unen para formar placas y masas, en sustitución del epiplón,
encierra circunferencialmente las vísceras, y la invasión de órganos sólidos,
mesenterio, y el diafragma. Estos tumores pueden tener una consistencia
gelatinosa, dependiendo del contenido en ácido hialurónico, y a medida que
progresan, obstruyen linfáticos peritoneales y producen líquido exudativo de sus superficies, lo que
resulta en ascitis.
Imagen 1:
macroscopía de un mesotelioma peritoneal maligno; nótense los nódulos difusos
en la superficie peritoneal.
El examen
histológico de secciones teñidas de rutina hematoxilina-eosina permite la
clasificación de MPM en uno de los tres subtipos histológicos: epitelioides, sarcomatoides, y bifásica
(mixtos); los patrones histológicos característicos son similares a los
encontrados en el mesotelioma pleural (imagen 2) 76. Mesotelioma tubulopapilar
(bien diferenciado), una variante poco frecuente que se ve más a menudo en el
peritoneo que en la pleura, se discute a continuación.
Imagen 2
Microscopía (hematoxilina-eosina) de los tres tipos histlógicos de MPM:
A:epitelioide, B: sarcomatoide, C: tubulopapilar
Al igual que en
la pleura, mesotelioma peritoneal con un componente sarcomatoide tienen un peor
pronóstico 45,77. En un informe, la mediana de supervivencia para los subgrupos
epitelioides de MPM fue de 55 meses, en comparación con 13 meses para el
sarcomatoide combinado y subtipos bifásicos 45.
La distinción
entre proliferaciones mesoteliales benignas y malignas es a veces un desafío:
La evidencia
histológica de invasión es el parámetro que define en la distinción entre
proliferaciones mesoteliales malignas o benignas. Sin embargo, incluso en la
biopsia o piezas quirúrgicas, las células mesoteliales son con frecuencia
objeto de atrapamiento en las adherencias, lóbulos de grasa y tejido
inflamatorio que pueden sugerir falsamente invasión del estroma.
La atipia y la
necrosis son más comunes en los tumores malignos, pero no son ni
suficientemente sensibles ni específicos para distinguir entre mesotelio
benigno y maligno.
Un prometedor
pero aún reciente método de investigación que pueden ayudar a diferenciar
mesotelioma benigno de malignos es la
inmunohistoquímica de la telomerasa.
En contraste con
los adenocarcinomas, MPM produce grandes cantidades de ácido hialurónico, y la
distinción se puede hacer fácilmente con el uso de hierro coloidal o azul
alcián y hialuronidasa.
● Otra
característica diferenciadora es la presencia o ausencia de mucina neutra tal
como se determina por el ácido periódico de Schiff (PAS) y diastasa; MPM está
invariablemente desprovista de mucina neutral 80-82.
● Los
mesoteliomas generalmente marcan negativo para otros marcadores de
adenocarcinoma, incluyendo CEA, LeuM1, Ber-Ep4, B72.3, BG8, y MOC-31.
● La mayoría de
los mesoteliomas presentan tinción positiva para calretinina, citoqueratinas
5/6, tumor de Wilms-1 (WT-1), trombomodulina, y mesotelina.
En general, la
tinción para citoqueratina 5/6,
calretinina y WT-1 (marcadores positivos para el mesotelioma), y CEA, Ber-Ep4,
LeuM1 y BG8 (negativo en el mesotelioma) representa el panel más útil de los
marcadores para MPM 63,67 , 76 se recomienda .El uso de al menos dos marcadores
de mesotelioma y dos marcadores de carcinoma 76.
Ocasionalmente,
cuando un mesotelioma epitelioide es extremadamente indiferenciado o si es una
variante desmoplásica, el análisis ultraestructural mediante microscopía
electrónica puede ser beneficiosa, aunque rara vez es necesaria. Entre los
pacientes que tienen un tumor primario peritoneal, la microscopía electrónica
es menos útil para la diferenciación de un mesotelioma sarcomatoso de un
sarcoma de tejidos blandos 40.
DIAGNÓSTICO
CLASIFICACIÓN
No hay un
sistema de estadificación aceptado uniformemente para MPM.
Debido a la baja
frecuencia de enfermedad
extraperitoneal, generalmente no se necesita una evaluación de estadificación
para metástasis a distancia, a menos que haya síntomas sugestivos de metástasis
en un órgano distante. Para los pacientes que se presentan con derrame pleural,
hay que realizar toracocentesis o cirugía toracoscópica videoasistida
(VATS) para eliminar la posibilidad
de tumor diseminado a la cavidad
pleural, lo que podría alterar el enfoque terapéutico. El sistema sistema de
estadificación "TNM" (estadio
T) peritoneo, la presencia de metástasis en los ganglios linfáticos
intraabdominales (N), y la ausencia o presencia enfermedad de extra-abdominal
(M) 54. T se calcula con base en el índice
de cáncer peritoneal ICP 83, una medida del volumen.
● Etapa I - T1
N0 M0; cinco años de supervivencia del 87 por ciento
● Etapa II -
T2-3 N0 M0; cinco años de supervivencia del 53 por ciento
● Etapa III - T4
N0-1 M0, T1-4 N1 M01-, y T1-4 N0-1 M1; cinco años de supervivencia del 29 por
ciento
El tratamiento
no será abordado en este apartado
Fuente UpToDte
REFERENCES
1 Teta MJ, Mink
PJ, Lau E, et al. US
mesothelioma patterns 1973-2002: indicators of change and insights into
background rates. Eur J Cancer Prev 2008; 17:525.
2 SEER Cancer Statistics
Review - Mesothelioma fast stats.
http://seer.cancer.gov/faststats/selections.php?series=cancer (Accessed on
April 03, 2012).
3 Boffetta P.
Epidemiology of peritoneal mesothelioma: a review. Ann Oncol 2007; 18:985.
4 Rodríguez D,
Cheung MC, Housri N, Koniaris LG. Malignant abdominal mesothelioma: defining
the role of surgery. J
Surg Oncol 2009; 99:51.
5 López-Ríos F,
Chuai S, Flores R, et al. Global
gene expression profiling of pleural mesotheliomas: overexpression of aurora
kinases and P16/CDKN2A deletion as prognostic factors and critical evaluation
of microarray-based prognostic prediction. Cancer Res 2006; 66:2970.
6 Borczuk AC,
Cappellini GC, Kim HK, et al. Molecular profiling of malignant peritoneal
mesothelioma identifies the ubiquitin-proteasome pathway as a therapeutic
target in poor prognosis tumors. Oncogene 2007; 26:610.
7 Robinson BW,
Lake RA. Advances in malignant mesothelioma. N Engl J Med 2005; 353:1591.
8 Watterson A,
Gorman T, Malcolm C, et al. The economic costs of health service treatments for
asbestos-related mesothelioma deaths. Ann N Y Acad Sci 2006; 1076:871.
9 Moolgavkar SH,
Meza R, Turim J. Pleural and peritoneal mesotheliomas in SEER: age effects and
temporal trends, 1973-2005. Cancer Causes Control 2009; 20:935.
10 Hemminki K,
Li X. Time trends and occupational risk factors for peritoneal mesothelioma in
Sweden. J Occup Environ Med 2003; 45:451.
11 Spirtas R,
Heineman EF, Bernstein L, et al. Malignant mesothelioma: attributable risk of
asbestos exposure. Occup Environ Med 1994; 51:804.
12 Averbach AM,
Sugarbaker PH. Peritoneal mesothelioma: treatment approach based on natural
history. Cancer Treat Res 1996; 81:193.
13 Niggli FK,
Gray TJ, Raafat F, Stevens MC. Spectrum of peritoneal mesothelioma in
childhood: clinical and histopathologic features, including DNA cytometry.
Pediatr Hematol Oncol 1994; 11:399.
14 Moran CA,
Albores-Saavedra J, Suster S. Primary peritoneal mesotheliomas in children: a
clinicopathological and immunohistochemical study of eight cases.
Histopathology 2008; 52:824.
15 Cioffredi LA, Jänne PA, Jackman DM. Treatment of peritoneal mesothelioma in pediatric
patients. Pediatr Blood Cancer 2009; 52:127.
16 Goldblum J,
Hart WR. Localized and diffuse mesotheliomas of the genital tract and
peritoneum in women. A clinicopathologic study of nineteen true mesothelial
neoplasms, other than adenomatoid tumors, multicystic mesotheliomas, and
localized fibrous tumors. Am J Surg Pathol 1995; 19:1124.
17 Kerrigan SA,
Turnnir RT, Clement PB, et al. Diffuse malignant epithelial mesotheliomas of
the peritoneum in women: a clinicopathologic study of 25 patients. Cancer 2002;
94:378.
18 Roggli VL,
Sharma A, Butnor KJ, et al. Malignant mesothelioma and occupational exposure to
asbestos: a clinicopathological correlation of 1445 cases. Ultrastruct Pathol
2002; 26:55.
19 Cocco P,
Dosemeci M. Peritoneal cancer and occupational exposure to asbestos: results
from the application of a job-exposure matrix. Am J Ind Med 1999; 35:9.
20 Newhouse ML,
Thompson H. Mesothelioma of pleura and peritoneum following exposure to
asbestos in the London area. 1965. Br J Ind Med 1993; 50:769.
21 Vianna NJ,
Polan AK. Non-occupational exposure to asbestos and malignant mesothelioma in
females. Lancet 1978; 1:1061.
22 Hodgson JT,
Darnton A. The quantitative risks of mesothelioma and lung cancer in relation
to asbestos exposure. Ann Occup Hyg 2000; 44:565.
23 McDonald AD,
McDonald JC. Malignant mesothelioma in North America. Cancer 1980; 46:1650.
24 Berry G, Reid
A, Aboagye-Sarfo P, et al. Malignant mesotheliomas in former miners and millers
of crocidolite at Wittenoom (Western Australia) after more than 50 years
follow-up. Br J Cancer 2012; 106:1016.
25 Amin AM,
Mason C, Rowe P. Diffuse malignant mesothelioma of the peritoneum following
abdominal radiotherapy. Eur J Surg Oncol 2001; 27:214.
26 Weissmann LB,
Corson JM, Neugut AI, Antman KH. Malignant mesothelioma following treatment for
Hodgkin's disease. J Clin Oncol 1996; 14:2098.
27 Antman KH,
Corson JM, Li FP, et al. Malignant mesothelioma following radiation exposure. J
Clin Oncol 1983; 1:695.
28 Baris I,
Simonato L, Artvinli M, et al. Epidemiological and environmental evidence of
the health effects of exposure to erionite fibres: a four-year study in the
Cappadocian region of Turkey. Int J Cancer 1987; 39:10.
29 Andersson M,
Wallin H, Jönsson M, et al. Lung carcinoma and malignant mesothelioma in
patients exposed to Thorotrast: incidence, histology and p53 status. Int J
Cancer 1995; 63:330.
30 van Kaick G,
Dalheimer A, Hornik S, et al. The german thorotrast study: recent results and
assessment of risks. Radiat Res 1999; 152:S64.
31 Ishikawa Y,
Mori T, Machinami R. Lack of apparent excess of malignant mesothelioma but
increased overall malignancies of peritoneal cavity in Japanese autopsies with
Thorotrast injection into blood vessels. J Cancer Res Clin Oncol 1995; 121:567.
32 Shivapurkar
N, Wiethege T, Wistuba II, et al. Presence of simian virus 40 sequences in
malignant pleural, peritoneal and noninvasive mesotheliomas. Int J Cancer 2000;
85:743.
33 Rivera Z, Strianese O, Bertino P, et al. The relationship between simian virus 40 and
mesothelioma. Curr Opin Pulm Med 2008; 14:316.
34 Riddell RH,
Goodman MJ, Moossa AR. Peritoneal malignant mesothelioma in a patient with
recurrent peritonitis. Cancer 1981; 48:134.
35 Gentiloni N,
Febbraro S, Barone C, et al. Peritoneal mesothelioma in recurrent familial
peritonitis. J Clin Gastroenterol 1997; 24:276.
36 Schiffman MH,
Pickle LW, Fontham E, et al. Case-control study of diet and mesothelioma in
Louisiana. Cancer Res 1988; 48:2911.
37 Sugarbaker
PH, Yan H, Grazi RV, Shmookler BM. Early localized peritoneal mesothelioma as
an incidental finding at laparoscopy. Report of a case and implications
regarding natural history of the disease. Cancer 2000; 89:1279.
38 Antman KH.
Clinical presentation and natural history of benign and malignant mesothelioma.
Semin Oncol 1981; 8:313.
39 Antman KH,
Blum RH, Greenberger JS, et al. Multimodality therapy for malignant
mesothelioma based on a study of natural history. Am J Med 1980; 68:356.
40 Levy AD,
Arnáiz J, Shaw JC, Sobin LH. From the archives of the AFIP: primary peritoneal
tumors: imaging features with pathologic correlation. Radiographics 2008;
28:583.
41 D'Abbicco D,
Conversano A, Epifania BR, et al. Splenic localization of the peritoneal
mesothelioma: case report and literature revue. Updates Surg 2012; 64:157.
42 Feldman AL,
Libutti SK, Pingpank JF, et al. Analysis of factors associated with outcome in
patients with malignant peritoneal mesothelioma undergoing surgical debulking
and intraperitoneal chemotherapy. J Clin Oncol 2003; 21:4560.
43 Acherman YI,
Welch LS, Bromley CM, Sugarbaker PH. Clinical presentation of peritoneal
mesothelioma. Tumori 2003; 89:269.
44 Kebapci M,
Vardareli E, Adapinar B, Acikalin M. CT findings and serum ca 125 levels in
malignant peritoneal mesothelioma: report of 11 new cases and review of the
literature. Eur Radiol 2003; 13:2620.
45 Sugarbaker
PH, Welch LS, Mohamed F, Glehen O. A review of peritoneal mesothelioma at the
Washington Cancer Institute. Surg Oncol Clin N Am 2003; 12:605.
46 van Gelder T,
Hoogsteden HC, Versnel MA, et al. Malignant peritoneal mesothelioma: a series
of 19 cases. Digestion 1989; 43:222.
47 Salemis NS,
Tsiambas E, Gourgiotis S, et al. Peritoneal mesothelioma presenting as an acute
surgical abdomen due to jejunal perforation. J Dig Dis 2007; 8:216.
48 Yan TD,
Deraco M, Baratti D, et al. Cytoreductive
surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal
mesothelioma: multi-institutional experience. J Clin Oncol 2009; 27:6237.
49 Baratti D,
Kusamura S, Cabras AD, et al. Lymph node metastases in diffuse malignant
peritoneal mesothelioma. Ann
Surg Oncol 2010; 17:45.
50 Pappa L,
Machera M, Tsanou E, et al. Subcutaneous
metastasis of peritoneal mesothelioma diagnosed by fine-needle aspiration.
Pathol Oncol Res 2006; 12:247.
51 Ordóñez NG,
Smith JL Jr. Peritoneal malignant mesothelioma with multiple distant skin
metastases. Arch Dermatol 1983; 119:827.
52 Baratti D,
Kusamura S, Cabras AD, et al. Diffuse malignant peritoneal mesothelioma:
Failure analysis following cytoreduction and hyperthermic intraperitoneal
chemotherapy (HIPEC). Ann Surg Oncol 2009; 16:463.
53 Roberts GH.
Distant visceral metastases in pleural mesothelioma. Br J Dis Chest 1976; 70:246.
54 Yan TD,
Deraco M, Elias D, et al. A
novel tumor-node-metastasis (TNM) staging system of diffuse malignant
peritoneal mesothelioma using outcome analysis of a multi-institutional
database*. Cancer 2011;
117:1855.
55 de Pangher
Manzini V. Malignant peritoneal mesothelioma. Tumori 2005; 91:1.
56 Ustündağ Y,
Can U, Benli S, et al. Internal
carotid artery occlusion in a patient with malignant peritoneal mesothelioma:
is it a sign of malignancy-related thrombosis? Am J Med Sci 2000; 319:265.
57 Eltabbakh GH,
Piver MS, Hempling RE, et al. Clinical picture, response to therapy, and
survival of women with diffuse malignant peritoneal mesothelioma. J Surg Oncol 1999; 70:6.
58 Manzini Vde
P, Recchia L, Cafferata M, et al. Malignant peritoneal mesothelioma: a multicenter study on 81 cases. Ann
Oncol 2010; 21:348.
59 Selleslag DL,
Geraghty RJ, Ganesan TS, et al. Autoimmune haemolytic anaemia associated with
malignant peritoneal mesothelioma. Acta Clin Belg 1989; 44:199.
60 Deraco M,
Bartlett D, Kusamura S, Baratti D. Consensus statement on peritoneal
mesothelioma. J Surg Oncol 2008; 98:268.
61 Szklaruk J,
Tamm EP, Choi H, Varavithya V. MR imaging of common and uncommon large pelvic
masses. Radiographics 2003; 23:403.
62 Low RN,
Barone RM. Combined diffusion-weighted and gadolinium-enhanced MRI can
accurately predict the peritoneal cancer index preoperatively in patients being
considered for cytoreductive surgical procedures. Ann Surg Oncol 2012; 19:1394.
63 Takeshima Y,
Amatya VJ, Kushitani K, Inai K. A useful antibody panel for differential
diagnosis between peritoneal mesothelioma and ovarian serous carcinoma in
Japanese cases. Am J Clin Pathol 2008; 130:771.
64 Ros PR,
Yuschok TJ, Buck JL, et al. Peritoneal mesothelioma. Radiologic appearances
correlated with histology. Acta Radiol 1991; 32:355.
65 Park JY, Kim
KW, Kwon HJ, et al. Peritoneal mesotheliomas: clinicopathologic features, CT
findings, and differential diagnosis. AJR Am J Roentgenol 2008; 191:814.
66 Yan TD,
Haveric N, Carmignani CP, et al. Computed tomographic characterization of
malignant peritoneal mesothelioma. Tumori 2005; 91:394.
67 Comin CE,
Saieva C, Messerini L. h-caldesmon, calretinin, estrogen receptor, and Ber-EP4:
a useful combination of immunohistochemical markers for differentiating
epithelioid peritoneal mesothelioma from serous papillary carcinoma of the
ovary. Am J Surg Pathol 2007; 31:1139.
68 Guest PJ,
Reznek RH, Selleslag D, et al. Peritoneal mesothelioma: the role of computed
tomography in diagnosis and follow up. Clin Radiol 1992; 45:79.
69 Baker PM,
Clement PB, Young RH. Malignant peritoneal mesothelioma in women: a study of 75
cases with emphasis on their morphologic spectrum and differential diagnosis.
Am J Clin Pathol 2005; 123:724.
70 Baratti D,
Kusamura S, Martinetti A, et al. Circulating CA125 in patients with peritoneal
mesothelioma treated with cytoreductive surgery and intraperitoneal
hyperthermic perfusion. Ann Surg Oncol 2007; 14:500.
71 Hassan R,
Remaley AT, Sampson ML, et al. Detection and quantitation of serum mesothelin,
a tumor marker for patients with mesothelioma and ovarian cancer. Clin Cancer
Res 2006; 12:447.
72 Hollevoet K,
Reitsma JB, Creaney J, et al. Serum mesothelin for diagnosing malignant pleural
mesothelioma: an individual patient data meta-analysis. J Clin Oncol 2012;
30:1541.
73
Wheatley-Price P, Yang B, Patsios D, et al. Soluble mesothelin-related Peptide
and osteopontin as markers of response in malignant mesothelioma. J Clin Oncol
2010; 28:3316.
74 Patel NP, Taylor CA, Levine EA, et al. Cytomorphologic features of primary peritoneal
mesothelioma in effusion, washing, and fine-needle aspiration biopsy specimens:
examination of 49 cases at one institution, including post-intraperitoneal
hyperthermic chemotherapy findings. Am J Clin Pathol 2007; 128:414.
75 Churg A,
Colby TV, Cagle P, et al. The separation of benign and malignant mesothelial
proliferations. Am J Surg Pathol 2000; 24:1183.
76 Husain AN,
Colby TV, Ordóñez NG, et al. Guidelines for pathologic diagnosis of malignant
mesothelioma: a consensus statement from the International Mesothelioma
Interest Group. Arch Pathol Lab Med 2009; 133:1317.
77 Hesdorffer
ME, Chabot JA, Keohan ML, et al. Combined resection, intraperitoneal
chemotherapy, and whole abdominal radiation for the treatment of malignant
peritoneal mesothelioma. Am J Clin Oncol 2008; 31:49.
78
Lyons-Boudreaux V, Mody DR, Zhai J, Coffey D. Cytologic malignancy versus
benignancy: how useful are the "newer" markers in body fluid
cytology? Arch Pathol Lab Med 2008; 132:23.
79 Onofre FB,
Onofre AS, Pomjanski N, et al. 9p21 Deletion in the diagnosis of malignant
mesothelioma in serous effusions additional to immunocytochemistry, DNA-ICM,
and AgNOR analysis. Cancer 2008; 114:204.
80 Corson JM.
Pathology of mesothelioma. Thorac Surg Clin 2004; 14:447.
81 Suzuki Y.
Diagnostic criteria for human diffuse malignant mesothelioma. Acta Pathol Jpn
1992; 42:767.
Peritoneum,
Preperitoneum, and Related Structures. In: Rosai and Ackerman's Surgical
Pathology, 9th, Rosai J (Ed), Mosby, 2004.
82 Jacquet P,
Sugarbaker PH. Clinical research methodologies in diagnosis and staging of
patients with peritoneal carcinomatosis. Cancer Treat Res 1996; 82:359.
83 Hoekman K,
Tognon G, Risse EK, et al. Well-differentiated papillary mesothelioma of the
peritoneum: a separate entity. Eur J Cancer 1996; 32A:255.
84 Hoekstra AV,
Riben MW, Frumovitz M, et al. Well-differentiated papillary mesothelioma of the
peritoneum: a pathological analysis and review of the literature. Gynecol Oncol
2005; 98:161.
85 Daya D,
McCaughey WT. Well-differentiated papillary mesothelioma of the peritoneum. A clinicopathologic study of 22 cases. Cancer 1990;
65:292.
86 Butnor KJ,
Sporn TA, Hammar SP, Roggli VL. Well-differentiated papillary mesothelioma. Am
J Surg Pathol 2001; 25:1304.
87 Lovell FA,
Cranston PE. Well-differentiated papillary mesothelioma of the peritoneum. AJR
Am J Roentgenol 1990; 155:1245.
88 Katsube Y,
Mukai K, Silverberg SG. Cystic mesothelioma of the peritoneum: a report of five
cases and review of the literature. Cancer 1982; 50:1615.
89 Weiss SW,
Tavassoli FA. Multicystic mesothelioma. An analysis of pathologic findings and
biologic behavior in 37 cases. Am J Surg Pathol 1988; 12:737.
90
González-Moreno S, Yan H, Alcorn KW, Sugarbaker PH. Malignant transformation of
"benign" cystic mesothelioma of the peritoneum. J Surg Oncol 2002;
79:243.
91 DeStephano
DB, Wesley JR, Heidelberger KP, et al. Primitive cystic hepatic neoplasm of
infancy with mesothelial differentiation: report of a case. Pediatr Pathol
1985; 4:291.
92 Sugarbaker P,
Yan T, Zappa L, et al. Thin-walled cysts as a pathognomonic CT finding in
cystic mesothelioma. Tumori 2008; 94:14.
93 Pickhardt PJ,
Bhalla S. Primary neoplasms of peritoneal and sub-peritoneal origin: CT
findings. Radiographics
2005; 25:983.