La Dra Ana Aquino y el Dr Jham Hinojosa, lectores y colaboradores del blog nos envían
dos casos de neurocisticercosis de diagnóstico reciente en los que les tocó
asistir a los pacientes.
Caso n° 1
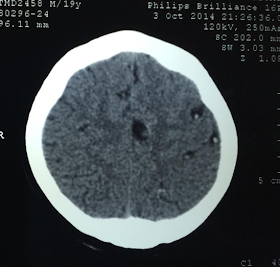
Varon de 19 años. Si antecedentes patológicos
previos .
Acude con tiempo de enfermedad de 20 minutos, de desvanecimiento y discurso incoherente, movimiento tónicos
clónicos generalizados de 2 minutos con post ictal de 2 minutos ( segun su compañera
de trabajo). No relajación de esfínteres .
Niega fiebre nauseas vómitos cefaleas .
Hace 1 año sucedió algo parecido.
Llegó caminado sin referir molestias. No recuerda el
episodio.
Al ex físico sin alteraciones
Hemograma 12000 leucocitos con 12% de eosinofilos
Presentó
Dra. Ana Aquino
Universidad Peruana Cayetano Heredia
Caso n° 2.
Doctor me comunico con usted para enviarle algunas
fotos de un paciente que vimos acá con Neurocisticercosis cerebral parenquimatosa que nos
fue referido al servicio de neurocirugía.El paciente tenía problemas de
conciencia con obnubilacion y enlentecimiento de la misma además de hemiparesia
izquierda, fue sometido a cirugia extrayendo el quiste del cisticerco con una
recuperacion en el post operatorio del 100% actualmente el paciente fue dado de
alta y continua medicacion con albendazol a 15 mg/kg dia mas prednisona 0.4
mg/kg
Residente de Neurocirugía
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DE LA CISTICERCOSIS
INTRODUCCIÓN.
La cisticercosis humana está producida
por la infestación de los tejidos por los cisticercos de la Taenia solium, a
los que se llamó, al ser interpretados originalmente como una especie distinta,
Cysticercus racemus.
En el ciclo vital de T. solium, el cisticerco que,
como todas las formas larvales de los cestodos aparece por lo general en un
hospedador diferente del que aloja al parásito definitivo, es una forma
intermedia en el desarrollo del parásito, entre el embrión hexacanto, presente
en los huevos liberados por los segmentos maduros del gusano con las heces del
hospedador, y el nuevo individuo adulto, que se desarrolla en el intestino de
las personas afectadas, a partir de la ingestión de carne porcina contaminada.
Cuando accidentalmente el ser humano incorpora los huevos embrionados del
parásito, desarrolla las formas larvales, convirtiéndose en hospedador
intermediario, pero en este caso, el ciclo se interrumpe. Puesto que el humano
es el único huésped definitivo de la T. solium, la prevalencia del complejo
teniasis/cisticercosis depende exclusivamente del vínculo que el hombre
establece con los animales y en particular con el cerdo (principal huésped
intermediario, junto con el jabalí) y, fundamentalmente, de sus hábitos
higiénicos y alimentarios.
Los síndromes clínicos relacionados con este
parásito se dividen en neurocisticercosis (NCC) y cisticercosis extraneural. La
neurocisticercosis, a su vez, se divide en formas parenquimatosas y
extraparenquimatosas. Las formas extraparenquimatosa incluyen la localización intraventricular,
subaracnoidea, intraocular, y la enfermedad de la médula.
La cisticercosis, caracterizada por la proliferación
de estos quistes o vesículas en los tejidos de diversos animales, depende de la
ingestión de los huevos de los parásitos liberados al ambiente por los
individuos portadores del gusano adulto, conocidos como huéspedes definitivos.
La infestación en el ser humano puede ocurrir de dos
maneras:
- Por ingestión de huevos del parásito emitidos con las heces de personas infestadas, por la vía fecal-oral. Para ello, las proglótides liberadas a la luz intestinal, las cuales tienen la facultad de moverse y arrastrarse por sí solas hasta el ano, causan prurito en el área perianal, de tal modo que al rascarse el enfermo recoge los huevos en sus dedos, ropa, sábanas, etc. y los esparce, siendo ingeridos por la misma persona o por otra que tenga contacto directo o indirecto con ella, a través, por ejemplo, de la manipulación de elementos contaminados, incluyendo el agua o alimentos.1
- Por autoinfestación a partir de la ruptura de los segmentos o proglótidos grávidos de los adultos alojados en el intestino del mismo hospedador, con lo que se liberarían huevos del parásito a la luz intestinal, que llegarían a las porciones anteriores del tracto digestivo por mecanismos antiperistálticos.
En ambos casos, el embrión liberado del huevo
penetra la pared del intestino y es transportado por los vasos sanguíneos a
cualquier lugar del cuerpo, donde se desarrollan los quistes. La ubicación
definitiva suele ser preferentemente el tejido cerebral, ocasionando
neurocisticercosis, y también pueden ubicarse en tejido subcutáneo, sobre todo
del pecho y la espalda, así como también pueden llegar a ubicarse en órganos
como el hígado y los riñones e, incluso, el ojo.
FISIOPATOLOGÍA.
Los cisticercos tisulares se desarrollan durante un
período de tres a ocho semanas después de la ingestión de huevos de T. solium
eliminados en las heces de un portador humano.
Los cisticercos se puede desarrollar en uno o varios sitios; durante la fase
inicial viable, los cisticercos no
causan mucha inflamación en los tejidos circundantes. Esta fase de la infección
suele ser asintomática y los cisticercos normalmente permanecen en esta etapa
durante muchos años.
Las tenias tienen sofisticados medios de evadir la
destrucción por parte del huésped, y a su vez el huésped tienen un número de mecanismos de tolerancia inmune. Los
metacestodos elaboran una variedad de sustancias, incluyendo taeniaestatina (un
inhibidor de la serina proteasa parasitaria), paramiosina, polisacáridos
sulfatados, y proteasas secretoras, que inhiben o desvían las respuestas
inflamatorias [1]. Taeniaestatina
también puede interferir con la proliferación de linfocitos y la función de los
macrófagos, inhibiendo de esta manera las defensas inmunitarias celulares
normales [1]. Las proteasas secretadas degradan moléculas anfitrionas
incluyendo citoquinas. Además, los anticuerpos humorales no matan a los
metacestodos maduros.
Eventualmente (después de un número variable de
años) los quistes degeneran y pierden su capacidad para modular la respuesta
inmune del huésped [2]. En ese momento las células inflamatorias atacan al
cisticerco, lo que conduce a la aparición de edema y / o realce en los estudios
de contraste en las imágenes. Esta respuesta inflamatoria se asocia con la aparición
de convulsiones. Moléculas inflamatorias del huésped tal como la sustancia P
pueden ser los causantes de convulsiones [3,4].
Finalmente las lesiones quísticas, o bien se resuelven o
forman un granuloma calcificado. Cuando están presentes, las calcificaciones se
asocian con convulsiones recurrentes, aunque el mecanismo de las convulsiones
asociadas con lesiones calcificadas no está claro. Las convulsiones pueden ser
el resultado de la inflamación, tal vez de la liberación de antígenos
intermitente, o de cicatrices [5,6]. Por otra parte, los cambios en la
plasticidad del cerebro y la cicatrización (por ejemplo, esclerosis del
hipocampo) pueden dar lugar a focos epileptógenos [7,8]. Los estudios han
puesto de manifiesto un posible papel de las metaloproteinasas de la matriz en
la patogénesis de las convulsiones en la neurocisticercosis, especialmente en pacientes
con lesiones calcificadas [9].
En contraste con la enfermedad del parénquima, que
se asocia con convulsiones, la enfermedad extraparenquimatosa se asocia con
síntomas de hidrocefalia [7,10]. Los
cisticercos en los ventrículos a menudo quedan atrapados en el foramen o
acueducto, causando hidrocefalia obstructiva. Cuando los cisticercos se
desarrollan en el espacio subaracnoideo, pueden causar efecto de masa (especialmente cuando se
encuentra en la cisura de Silvio) o una respuesta inflamatoria que puede
conducir a aracnoiditis crónica. La aracnoiditis puede ir acompañada de
hidrocefalia comunicante, vasculitis, meningitis, y accidentes cerebrovasculares [10]. Los pacientes con frecuencia tienen quistes en más de un
lugar, y no es raro tener lesiones viables, inflamadas, y calcificadas
presentes en el mismo paciente.
Algunos expertos han denominado a los cisticercos
como "activos" si son viables o en proceso de degeneración. Si los granulomas
se visualizan calcificados radiográficamente en ausencia de cisticercos las lesiones
se consideran "inactivas". Quistes activos e inactivos pueden estar
presentes en el mismo paciente simultáneamente. Sin embargo, estos términos no
se correlacionan con los síntomas o la respuesta inflamatoria del huésped y
probablemente deberían abandonarse.
MANIFESTACIONES CLÍNICAS.
Las manifestaciones clínicas dependen de si los
quistes se localizan en el parénquima cerebral, los tejidos
extraparenquimatosos, o ambos. En general, los quistes parenquimatosos están
asociados con convulsiones y cefalea, mientras que los quistes
extraparenquimatosos están asociados con síntomas de hipertensión endocraneana
(cefalea, náuseas y vómitos) y pueden ir acompañados de un estado mental
alterado. Otras manifestaciones menos comunes incluyen efecto de masa, visión alterada, signos
neurológicos focales, alteración del estado mental, y meningitis. La fiebre no está normalmente
presente. El examen neurológico por lo general no muestra signos focales en ausencia de efecto de masa o un derrame
cerebral.
NEUROCISTICERCOSIS PARENQUIMATOSA.
Los quistes parenquimatossos, o lesiones que
realzan en las imágenes son las formas
más comunes en los pacientes internados. Son las lesiones más comunes y se ven en más
del 60% de los pacientes. [2,11-14]. El inicio de los síntomas se ha estimado
en un pico de tres a cinco años después de la infección, pero puede aparecer 30
años después [13,15,16]. Inicio más tardío puede ser debido a las lesiones
calcificadas.
La evaluación de los estudios de imagen en zonas
endémicas ha sugerido que la mayor parte de las infecciones parénquimatosas nunca causan síntomas ; como
resultado, muchos casos se encuentran incidentalmente durante procedimientos de
imagen o nunca se diagnostican [17-19]. Sin embargo, algunas pequeñas
calcificaciones nodulares (generalmente de 1 a 10 mm de diámetro), pueden ser una causa importante de epilepsia [5,17,20,21].
Las manifestaciones clínicas dependen de la
localización y el número de parásitos y la respuesta inflamatoria asociada
[2,14,22]. Las convulsiones son las manifestaciones clínicas más comunes de
cisticercosis del parénquima y suelen ser focales, pero pueden tener
generalización secundaria [2,12,13,20,23-25]. Los niños con
neurocisticercosis típicamente se presentan con convulsiones y una sola lesión;
esta presentación también es muy común entre los adultos (por ejemplo, en India
y América). En muchos países con
neurocisticercosis endémica, la neurocisticercosis es la causa más común de convulsiones de
inicio en el adulto [2,20,22].
En el contexto de un número masivo de quistes en el parénquima
cerebral, una respuesta inmunitaria intensa con edema cerebral difuso puede
causar un cuadro clínico que se asemeja a encefalitis. Este síndrome se puede presentarse
con convulsiones, dolor de cabeza, náuseas y vómitos, alteración de la
conciencia, disminución de la agudeza visual, y en ocasiones fiebre. Puede
ocurrir de forma espontánea o puede ser provocada por la terapia que hace que
un gran número de quistes degeneren simultáneamente. Esta manifestación es
más común en los niños y las mujeres jóvenes.
El pronóstico varía con el número de cisticercos y
el grado de la inflamación [22]. Los pacientes con lesiones únicas por supuesto tienen un
pronóstico más favorable que aquellos con cisticercos viables múltiple.
NEUROCISTICERCOSIS EXTRAPARENQUIMATOSA
Los cisticercos extraparenquimatosos puede ocurrir en el espacio intraventricular o
subaracnoideo. La hidrocefalia parece ser más común en los adultos que en los
niños (que son más propensos a tener enfermedad del parénquima) [11]. Otras
manifestaciones de neurocisticercosis extraparenquimatosa incluyen enfermedad de la médula y del ojo.
Quistes intraventriculares.
Los cisticercos que se desarrollan en el sistema
ventricular (como quistes que flotan libres en la cavidad ventricular o
adheridas a los plexos coroideos), se ven en 10 a 20 por ciento de los pacientes que
consultan. Generalmente, los síntomas se desarrollan cuando los cisticercos se
alojan en las vías de salida del ventrículo, con la consiguiente hidrocefalia
obstructiva y aumento de la presión intracraneal de inicio gradual a agudo. [13,14,26].
Los síntomas asociados incluyen dolores de cabeza, náuseas y vómitos, alteración
del estado mental, y disminución de la agudeza visual asociada con edema de
papila. Los síntomas menos frecuentes son convulsiones y signos neurológicos focales.
Quistes móviles en el cuarto ventrículo en ocasiones pueden causar obstrucción
intermitente, dando lugar a episodios de pérdida súbita de la conciencia
relacionada con movimientos de la cabeza (síndrome de Bruns) [27].
Quistes subaracnoideos.
Los cisticercos que se alojan en el espacio subaracnoideo de las cisuras o cisternas basilares puede generar una respuesta inflamatoria que conduce a aracnoiditis crónica, que puede ir acompañada de hidrocefalia, meningitis, apoplejía y vasculitis [10,13,14,26,28] . Los pacientes con neurocisticercosis subaracnoidea basal son más propensos a tener la participación del espacio subaracnoideo espinal de pacientes con quistes cerebrales intraparenquimatosa sólo [29].
Los cisticercos que se alojan en el espacio subaracnoideo de las cisuras o cisternas basilares puede generar una respuesta inflamatoria que conduce a aracnoiditis crónica, que puede ir acompañada de hidrocefalia, meningitis, apoplejía y vasculitis [10,13,14,26,28] . Los pacientes con neurocisticercosis subaracnoidea basal son más propensos a tener la participación del espacio subaracnoideo espinal de pacientes con quistes cerebrales intraparenquimatosa sólo [29].
Oclusión secundaria de los agujeros de Luschka o
Magendie puede provocar hidrocefalia obstructiva. Además, la inflamación de las
meninges y engrosamiento leptomeníngeo en la base del cerebro pueden llevar a
defectos del campo visual y parálisis de los nervios craneales debido al
atrapamiento de los nervios craneales que surgen del tronco cerebral.
Afectación vascular puede conducir a angeítis proliferativa y obstrucción
vascular con infartos cerebrales secundarios [10,28,30,31]. Signos focales
neurológicos motor, ataxia y disfunción sensorial puede sobrevenir; esta
presentación tiende a estar asociada con un pronóstico relativamente malo.
Cisticercosis racemosa
Cisticercosis racemosaes un término antiguo de la cisticercosis que se caracteriza por la proliferación de quistes lobulados sin escólex, que generalmente se encuentran en el espacio subaracnoideo. Estos cisticercos se cree que tienen un crecimiento desproporcionado de su membrana que se agrupan en racimos, y se asemeja a racimos de uvas. Es muy difícil distinguir esta forma de otras formas de cisticercosis subaracnoidea clínica o radiográficamente.
Cisticercosis racemosaes un término antiguo de la cisticercosis que se caracteriza por la proliferación de quistes lobulados sin escólex, que generalmente se encuentran en el espacio subaracnoideo. Estos cisticercos se cree que tienen un crecimiento desproporcionado de su membrana que se agrupan en racimos, y se asemeja a racimos de uvas. Es muy difícil distinguir esta forma de otras formas de cisticercosis subaracnoidea clínica o radiográficamente.
Los cisticercos en el espacio subaracnoideo puede
crecer hasta 10 cm o más. Esto es particularmente común con cisticercos en la
cisura de Silvio, ya que no están limitados por la presión de la parénquima
cerebral [2,10]. Estos cisticercos, denominan "cisticercos gigantes",
y se acompañan de inflamaciónque puede
causar efecto de masa y signos
neurológicos focales.
Cisticercosis espinal.
El compromiso de la médula espinal se produce en aproximadamente el 1 por ciento de los casos [32,33]. Además, muchos casos de cisticercosis subaracnoidea intracraneal también tienen lesiones en la médula [29]. Los cisticercos espinales están generalmente ubicados en el espacio subaracnoideo donde pueden causar cambios inflamatorios y desmielinizantes en las raíces de los nervios periféricos. Generalmente, los pacientes se presentan con dolor radicular, parestesias y / o trastornos de esfínteres. Déficits neurológicos varían con la localización de la lesión y no pueden distinguirse clínicamente de otras lesiones de la médula espinal.
El compromiso de la médula espinal se produce en aproximadamente el 1 por ciento de los casos [32,33]. Además, muchos casos de cisticercosis subaracnoidea intracraneal también tienen lesiones en la médula [29]. Los cisticercos espinales están generalmente ubicados en el espacio subaracnoideo donde pueden causar cambios inflamatorios y desmielinizantes en las raíces de los nervios periféricos. Generalmente, los pacientes se presentan con dolor radicular, parestesias y / o trastornos de esfínteres. Déficits neurológicos varían con la localización de la lesión y no pueden distinguirse clínicamente de otras lesiones de la médula espinal.
Con menor frecuencia, la cisticercosis intramedular
puede ocurrir y puede asociarse a mielitis transversa.
Cisticercosis ocular
La cisticercosis ocular ocurre en aproximadamente 1 a 3 por ciento de los casos [34]. Los pacientes con cisticercosis ocular pueden tener afectación el espacio subretiniano, humor vítreo, cámara anterior, conjuntiva o los músculos extraoculares. Los síntomas pueden incluir problemas de visión, dolor ocular recurrente y diplopía.
La cisticercosis ocular ocurre en aproximadamente 1 a 3 por ciento de los casos [34]. Los pacientes con cisticercosis ocular pueden tener afectación el espacio subretiniano, humor vítreo, cámara anterior, conjuntiva o los músculos extraoculares. Los síntomas pueden incluir problemas de visión, dolor ocular recurrente y diplopía.
Los pacientes con cisticercos subretinianos puede
considerarse que tienen neurocisticercosis; la presencia de
cisticercos en la cámara anterior del ojo es una forma de cisticercosis
extraneural. Aunque muchos pacientes están asintomáticos, la inflamación alrededor de los cisticercos en
degeneración puede comprometer la visión
al causar coriorretinitis, desprendimiento de retina, o vasculitis. La cisticercosis
ocular debe excluirse por un examen oftalmológico en todos los pacientes con
NCC antes de iniciar la terapia.
Cisticercosis extraneural
La cisticercosis extraneural puede incluir una amplia gama de tejidos, pero se diagnostica normalmente en forma casual cuando se procede a la fijación de los músculos o del tejido subcutáneo. Quistes cardíacos también se han descrito [2]. Dependiendo de su ubicación, estos pueden ser asintomáticos o pueden dar lugar a arritmias y / o alteraciones de la conducción.
La cisticercosis extraneural puede incluir una amplia gama de tejidos, pero se diagnostica normalmente en forma casual cuando se procede a la fijación de los músculos o del tejido subcutáneo. Quistes cardíacos también se han descrito [2]. Dependiendo de su ubicación, estos pueden ser asintomáticos o pueden dar lugar a arritmias y / o alteraciones de la conducción.
Cisticercosis subcutánea e intramuscular. La cisticercosis muscular o subcutánea es más
común en pacientes de Asia y África que de América Latina. No se sabe si las oncosferas
migran activamente a tejidos específicos o entran en los tejidos de forma pasiva
[1]. Los pacientes pueden notar nódulos
subcutáneos de 0,5 a 2,0 cm de
diámetro; los cisticercos en estos sitios suelen ser asintomáticos, pero puede
causar incomodidad cuando se inflaman. Quistes intramusculares a menudo se calcificacan y pueden ser detectados
incidentalmente como "calcificaciones en forma de cigarro", en
radiografías que se realizan por razones
no relacionadas [2]. En el contexto de una amplia participación muscular puede desarrollarse miopatía aguda.
DIAGNÓSTICO.
El diagnóstico de neurocisticercosis se basa en gran
parte en la presentación clínica y las imágenes. [2,14,35,36]. Las pruebas
serológicas pueden ser útiles, pero no siempre son necesarias; rara vez se
requieren procedimientos invasivos tales como la biopsia cerebral.
El alcance de la evaluación diagnóstica necesaria
depende de la presentación clínica [36]. Por ejemplo, en un paciente de un área
endémica que presentan convulsiones (en ausencia de signos focales
neurológicos, fiebre, sudores, o evidencia de otras enfermedades), junto con
una lesión típica como único dato, sin desplazamiento
de la línea media en las imágenes cerebrales, la probabilidad del diagnóstico
de neurocisticercosis es muy alta [35,37], y otros procedimientos de
diagnóstico pueden no ser necesarios. Sin embargo, para los casos en que el
diagnóstico es menos claro, una evaluación diagnóstica adicional puede estar
justificada, incluyendo pruebas
serológicas.
Se han propuesto criterios diagnósticos basados
en: clínica, imagenología,
inmunológicas, y los datos epidemiológicos [36]. Estos incluyen
categorías estratificadas sobre la base de su fuerza de diagnóstico (absoluto,
mayores, menores y epidemiológica). La interpretación de estos criterios
permite grados definitivos o probables de certeza diagnóstica.
Imágenes
Las imágenes radiológicas
son una herramienta importante para el diagnóstico de neurocisticercosis y
cisticercosis extraneural. Los pacientes con sospecha de NCC deben ser
evaluados con tomografía computarizada (TC) o resonancia magnética (MRI) del cerebro; La
TC es a menudo suficiente a los fines de
diagnósticos aunque la RMN es útil en
algunas situaciones como veremos a continuación. Además, los pacientes con NCC
subaracnoidea basal deben someterse a imágenes de espina dorsal [29]. Los
hallazgos radiológicos dependen de la localización y el estadio de la lesión
(s) y la respuesta inmune del huésped.
En la neurocisticercosis parenquimatosa, los cisticercos
tienden a alojarse en la corteza cerebral o en el tronco cerebral; el
desplazamiento de las estructuras de la línea media es raro. Lesiones
quísticas y calcificadas pueden
estar presentes en un mismo paciente simultáneamente. Los quistes viables son redondos,
hipodensos que no realzan con el contraste
generalmente, y de 5 a 20 mm de diámetro. A medida que el quiste comienza a
degenerar, la pared del quiste aumenta su densidad y suele ir acompañada de
edema o realce del contraste. Posteriormente, la cavidad aumenta de densidad y
puede realzar con contraste. Tras el
colapso del quiste, se puede ver un granuloma calcificado residual; las calcificaciones
son por lo general lesiones nodulares sólidas de 2 a 4 mm de diámetro (rango de
1 a 10 mm).
Los hallazgos más comunes de la NCC
parenquimatosa incluye la participación
del tronco cerebral, cerebelo o los ganglios basales, efecto de masa, edema
cerebral difuso, infarto cerebral, quistes gigantes de más de 20 cm y múltiples
quistes, hasta más de 50.
En la neurocisticercosis extraparenquimatosa se puede visualizar con imágenes cerebrales
dependiendo de la localización de las lesiones. Las manifestaciones pueden
incluir quistes intraventriculares, quistes subaracnoideos, realce
leptomeníngeo, o hidrocefalia con dilatación ventricular. La TC también es útil para el diagnóstico de infestación de cisticercosis del ojo y músculos extraoculares [34,38].
La identificación de un escólex en una lesión
quística es el único hallazgo radiológico patognomónico. Los escólices aparecen
nódulos brillantes redondeados o
alargados de 2 a 4 mm de diámetro dentro de la cavidad del quiste. Normalmente,
el escólex no es identificable en las lesiones calcificadas, pero en ocasiones
puede ser visible en la RM. Otros hallazgos radiográficos altamente sugestivos
de neurocisticercosis incluyen lesiones quísticas, aumento de lesiones y calcificaciones en
parénquima cerebral. Los hallazgos radiológicos compatibles con
neurocisticercosis incluyen hidrocefalia, realce leptomeníngeo y mielogramas
con defectos de llenado con contraste.
La TC es menos costosa que la RMN, es excelente para
la detección de calcificaciones, y es a menudo suficiente para hacer el
diagnóstico. La RM es útil para la detección de lesiones relativamente
pequeñas, así como las lesiones intraventriculares y subaracnoideas. También es
útil para evaluar los cambios degenerativos, edema alrededor de las lesiones
calcificadas, y para visualizar escólices dentro de las lesiones calcificadas
[36,38-44]. Mientras que las lesiones quísticas son generalmente visibles sin contraste, el contraste facilita la
visualización de las imágenes. El FLAIR
en la RM es particularmente útil en la identificación de cisticercos en el
parénquima, y las imágenes FIESTA (reconstrucciones finas), son útiles para la identificación de los
cisticercos en el líquido cefalorraquídeo. Los cisticercos del parénquima
finalmente degeneran de forma espontánea o después del tratamiento con
albendazol. Por lo tanto, la resolución de las lesiones, ya sea espontáneamente
o después de la terapia antiparasitaria se piensa que es muy sugestiva de la
neurocisticercosis.
Las radiografías simples puede ser útiles para la
evaluación de cisticercosis extraneural
tales como lesiones calcificadas ("calcificaciones en forma de
cigarro") en el músculo o tejido subcutáneo, aunque la TC es más sensible
a estos hallazgos. En un estudio de 25 pacientes con lesiones cerebrales
intraparenquimatosas calcificadas, sin contraste de imagen de TC de los muslos
demostraron una o más calcificaciones
musculares compatibles con cisticercosis extraneural en el 52 por ciento de los
casos; las calcificaciones eran visibles en las radiografías simples en sólo el
46 por ciento de estos casos [45].
Para la evaluación de las lesiones de la médula
espinal La RM es superior a la TC; mielografía también puede ser útil.
Serología.
Las pruebas serológicas son un complemento
importante en casos de sospecha de cisticercosis cuando los estudios de
neuroimágenes no son diagnósticos. Sin embargo, la serología negativa no
excluye el diagnóstico en pacientes con un cuadro clínico y hallazgos
radiográficos compatibles. Además, para las personas de zonas altamente endémicas con resultados
serológicos positivos también es importante tener en cuenta la posibilidad de
una infección previa y / o la cisticercosis extraneural.
Una serie de pruebas serológicas se han desarrollado
en suero y LCR. Algunos ensayos detectan
anticuerpos anticisticerco; otros a identificar antígenos de cisticerco. Una
variedad de técnicas se pueden utilizar para detectar anticuerpos contra T.
solium, incluyendo ensayo de inmunoabsorción enzimática (ELISA), fijación del complemento (FC),
radioinmunoensayo, hemaglutinación y de inmunotransferencia. En general, los
ensayos para la detección de anticuerpos contra los antígenos específicos de T.
solium son preferibles a los ensayos que emplean antígenos no fraccionados, que
tienen escasa especificidad y sensibilidad [46,47].
La prueba de elección para la detección de
anticuerpos es la inmunoelectrotransferencia ligado a enzimas
(EITB) desarrollado por los CDC [36]. El ensayo EITB se puede realizar en suero
o LCR pero la sensibilidad es generalmente más alta con suero [48].Ttiene mayor
sensibilidad y especificidad que las pruebas de ELISA (83 a 100 versus casi 100 por ciento)
[46-48]. Los resultados falsos positivos
son raros.
El rendimiento diagnóstico de la EITB puede variar
en diferentes poblaciones de pacientes dependiendo de la actividad del quiste y
número de lesiones. En un estudio de 50 pacientes con neurocisticercosis confirmados
anatomopatológicamente , los anticuerpos detectables se observaron con mayor
facilidad en los pacientes con dos o más lesiones que en los pacientes con una
lesión única (94 frente a 28 por ciento, respectivamente) [48]. Los pacientes
con quistes sólo calcificados (simples o múltiples) también fueron menos
propensos a tener resultados positivos que aquellos con EITB, el aumento de
lesiones calcificadas. Además, los anticuerpos pueden persistir durante años
después de la muerte de los parásitos, por lo que una prueba de anticuerpos
positiva no indica necesariamente la presencia de parásitos vivos o enfermedad
activa [51].
Examen de fondo de ojo
La
visualización directa del parásito mediante un examen del fondo de ojo es
patognomónico para el diagnóstico de la cisticercosis [36]. Aunque la cisticercosis ocular es relativamente poco
común y muchos pacientes están asintomáticos, la inflamación alrededor de los
cisticercos en degeneración puede amenazar la visión, particularmente en el
contexto del tratamiento antiparasitario. Por esta razón, la cisticercosis
ocular debe excluirse por un examen oftalmológico en todos los pacientes con
NCC antes de iniciar la terapia.
Estudios del LCR.
Una punción lumbar para examen del LCR por lo
general no es necesaria para el diagnóstico de NCC, pero puede ser útil para
excluir otros diagnósticos. Este procedimiento está contraindicado en el
contexto de un aumento de la presión intracraneal.
Si una punción lumbar se realiza en el contexto de lesiones del parénquima, el examen del LCR
típicamente demuestra los recuentos de células blancas ligeramente elevados con
concentraciones normales de glucosa y proteína. En el contexto de aracnoiditis
activa o ventriculitis sin embargo, hay pleocitosis con concentraciones de
proteína marcadamente elevadas y disminución de las concentraciones de glucosa.
Los recuentos de células pueden presentar un predominio de células
mononucleares, neutrófilos o eosinófilos [58]. El diagnóstico diferencial de
una pleocitosis eosinofílica incluye coccidioidomicosis, gnatostomiasis,
baylisascariasis, angiostrongyloidiasis, y
causas no infecciosas.
La inmunoelectrotransferencia (EITB) ligada a enzima
se puede realizar en suero o LCR pero la sensibilidad es generalmente más alta
con suero. Ensayos de detección de antígeno son más sensibles con CSF.
Patología
La biopsia cerebral se justifica sólo en casos
excepcionales para los que la prueba no invasiva es insuficiente para
establecer el diagnóstico de la cisticercosis. Sin embargo, la biopsia
excisional de una lesión de piel o músculo puede ser útil para el diagnóstico de cisticercosis extraneural.
Un cisticerco viable aparece como una membrana llena
de líquido translúcido (alrededor de 5 a 10 mm de diámetro) que contienen un
sólido escolex o tenia larval (2 mm de longitud). La histopatología demuestra
típicamente paredes membranosas llenas de líquido. Con menos frecuencia,
escólex (compuesto por órganos rudimentarios y cabezas con ventosas y ganchos)
también pueden ser visualizados; este hallazgo es patognomónico para el
diagnóstico de la cisticercosis [59]. El grado de inflamación puede ser variable.
A medida que el parásito se degenera, los colapsos de la cavidad del quiste y
las paredes de parásitos son incorporados gradualmente en la inflamación
granulomatosa. El escólex por lo general
no puede ser identificado en lesiones calcificadas.
Laboratorio
La mayoría de
los pacientes con cisticercosis no tienen ninguna dato diagnóstico específico
en los recuentos sanguíneos de rutina y pruebas de función hepática. La eosinofilia
periférica suele estar ausente. El examen de las heces es insensible ya que la
mayoría de los individuos con cisticercosis no tienen una tenia intestinal
viable en el momento del diagnóstico.
Enfoque clínico.
Un enfoque clínico razonable para el diagnóstico de
la cisticercosis es comenzar con una TC del cerebro y serología con inmunoelectrotransferencia
ligado a enzimas (EITB). Si los resultados de la TC no son concluyentes en el
entorno de una alta sospecha clínica, la resonancia magnética es adecuada para
la evaluación de lesiones pequeñas, subaracnoidea o intraventricular lesiones,
y la visualización de escolex [18,41]. Si la aparición en las imágenes
radiográficas no es específica y pruebas serológicas son negativas, puede que
no sea posible diferenciar NCC de otras lesiones cerebrales como absceso o
tumor maligno.
Cisticercosis ocular debe excluirse por un examen
oftalmológico en todos los pacientes con NCC antes de iniciar la terapia. No
hay estudios de laboratorio de rutina son necesarios; los pacientes a menudo no
tienen eosinofilia periférica significativa.
DIAGNÓSTICO DIFERENCIAL .
Otras condiciones que pueden simular lesiones únicas
o múltiples incluyen tuberculomas, abscesos cerebrales, granulomas piógenos
micóticas y tumores cerebrales primarios
o metastásicos. Las lesiones quísticas del cerebro incluyen equinococosis quística, cenurosis y gliomas
quísticos y glioblastomas. Calcificaciones cerebrales parenquimatosas se pueden
encontrar en trastornos metabólicos, malformaciones vasculares intracraneales,
neoplasias, anomalías congénitas y otras infecciones. Aracnoiditis con
dilatación ventricular se puede observar en el contexto de meningitis
tuberculosa y micótica y carcinomatosis meníngea.
Tratamiento.
El tratamiento óptimo para los pacientes con
neurocisticercosis sintomática (NCC) no siempre es sencillo y depende de muchos
factores, incluyendo la ubicación, el número y tipo de quistes. A pesar de
muchas incertidumbres, algunos principios acuerdo general adoptado por la
mayoría de los expertos para el manejo de situaciones específicas:
Tratamiento antiepiléptico
La terapia con fármacos antiepilépticos debe
administrarse a los pacientes que se presentan con convulsiones. Sugerimos el
tratamiento antiepiléptico en los pacientes que no presentan con convulsiones,
pero se encuentran en alto riesgo de sufrir convulsiones. El riesgo de ataques parece
ser mayor cuando hay múltiples lesiones,
especialmente cuando las lesiones están degeneradas y rodeadas por
inflamación. Lesiones inactivas
calcificadas también pueden ser focos epilépticos pero no se consideran
generalmente una indicación para el tratamiento antiepiléptico profiláctico en
pacientes asintomáticos.
Se administra
tratamiento antiepiléptico durante seis
a doce meses después de la resolución radiológica de infección parasitaria
activa, seguido de un juicio fuera de la terapia antiepiléptica. Las
convulsiones recurrentes deben pedirá reiniciar el tratamiento antiepiléptico
crónico. (Ver "terapia antiepiléptica" arriba.)
Terapia antiparasitaria
Para los
pacientes con un quiste único y realce con contraste sugerimos tratamiento con
antiparasitarios y corticosteroides.
Para los pacientes con quistes múltiples, sugerimos
tratamiento con antiparasitarios y corticosteroides . Sin embargo, se
recomienda NO administrar terapia antiparasitaria para los pacientes con
edema cerebral difuso asociado con cisticercos múltiple con inflamación; estos pacientes
deben ser tratados con terapia de
corticosteroides solo.
Para los pacientes con quistes calcificados (en
ausencia de lesiones viables) no ameritan terapia antiparasitaria; los medicamentos
antiparasitarios no son útiles en ausencia de parásitos viables.
Para los pacientes con quistes subaracnoideos, se
recomienda el tratamiento con antiparasitarios y terapia con corticosteroides . La duración del
tratamiento y la elección de los agentes y las dosis deben ser
individualizadas. Las personas con hidrocefalia también requieren derivación de
LCR.
Para los pacientes con quistes intraventriculares o
espinales en sitios anatómicos accesibles a la resección endoscópica, sugerimos
la resección endoscópica . Otros pacientes requieren un enfoque individualizado
incluyendo la terapia antiparasitaria, terapia con corticosteroides, y / o intervención
quirúrgica.
Para los pacientes con afectación de los músculos
extraoculares o nervio óptico, sugerimos la terapia antiparasitaria y
corticosteroides . Para los pacientes con enfermedad intraocular, sugerimos la
escisión quirúrgica.
Para los pacientes con lesiones subcutáneas o
intramusculares sintomáticos, sugerimos tratamiento con medicamentos
antiinflamatorios no esteroideos. Si los síntomas persisten, la extirpación de
lesiones solitarias puede ser consideradA.
El tratamiento antiparasitario consiste en
albendazol 15 mg / kg por día (por lo
general de 800 mg / día en dos dosis divididas; se toma con alimentos para
aumentar la biodisponibilidad). La combinación de albendazol 15 mg / kg por
día, junto con praziquantel 50 mg / kg por día puede ser más eficaz.
La duración
óptima del tratamiento depende del tipo de enfermedad. Para los pacientes con
una única lesión con realce , sugerimos tratamiento durante siete días. Para
los pacientes con múltiples lesiones quísticas, sugerimos el tratamiento
durante 10 a 14 días. Para los pacientes con enfermedad subaracnoidea, se
sugiere el tratamiento durante al menos 28 días.
Se recomienda la administración concomitante de
corticoides . Una dosis típica es de 1 mg / kg / día de prednisona o
prednisolona o 0,1 mg / kg / día de dexametasona durante 5 a 10 días.
Cirugía
Se recomienda que los pacientes con alteración del
estado mental o herniación inminente debido a la hidrocefalia asociada con NCC .
Esto se puede lograr a través de ventriculostomía o la colocación de una
derivación ventrículo-peritoneal.
Se sugiere la extracción endoscópica de los quistes
intraventriculares para los pacientes con hidrocefalia . Medicamentos
antiparasitarios no deben administrarse antes de la cirugía, ya que pueden
debilitar la membrana quiste, causando la friabilidad y / o adherencia a la
pared ventricular. Medicamentos antiparasitarios y corticosteroides no son
necesarias en la mayoría de los casos después de la extirpación del quiste
Se recomienda la resección quirúrgica abierta para
pacientes con cisticercos gigante y efecto de masa en peligro de vida y cisticercos en sitios inaccesibles por
endoscopia flexible (como NCC ocular o
médula).
1White AC, Jr,
Robinson P, Kuhn R. Taenia solium cysticercosis: Host-parasite interactions and
the immune response. In: Immunopathogenetic Aspects of Disease Induced by
Helminth Parasites, Freedman DO (Ed), Karger, Basel 1997. p.209.
2Garcia HH,
Coyle CM, White AC Jr. Cysticercosis. In: Tropical Infectious Diseases:
Principles, Pathogens, and Practice, Guerrant RL, Walker DH, Weller PF. (Eds),
Churchil-Livingstone, Philadelphia 2011. p.815.
3Stringer JL,
Marks LM, White AC Jr, Robinson P. Epileptogenic activity of granulomas
associated with murine cysticercosis. Exp Neurol 2003; 183:532.
4Robinson P,
Garza A, Weinstock J, et al. Substance P causes seizures in neurocysticercosis.
PLoS
Pathog 2012; 8:e1002489.
5Nash TE, Del Brutto OH, Butman JA, et al. Calcific neurocysticercosis and epileptogenesis.
Neurology 2004; 62:1934.
6Nash TE, Pretell EJ, Lescano AG, et al. Perilesional brain oedema and seizure activity in
patients with calcified neurocysticercosis: a prospective cohort and nested
case-control study. Lancet Neurol 2008; 7:1099.
7Singla M, Singh
P, Kaushal S, et al. Hippocampal sclerosis in association with neurocysticercosis.
Epileptic Disord 2007; 9:292.
8Rathore C,
Thomas B, Kesavadas C, Radhakrishnan K. Calcified neurocysticercosis lesions
and hippocampal sclerosis: potential dual pathology? Epilepsia 2012; 53:e60.
9Gupta RK,
Awasthi R, Rathore RK, et al. Understanding epileptogenesis in calcified
neurocysticercosis with perfusion MRI. Neurology 2012; 78:618.
10Garcia HH, Del Brutto OH, Nash TE, et al. New concepts in the diagnosis and management of
neurocysticercosis (Taenia solium). Am J Trop Med Hyg 2005;
72:3.
11Sáenz B, Ruíz-Garcia M, Jiménez E, et al. Neurocysticercosis: clinical, radiologic, and
inflammatory differences between children and adults. Pediatr Infect Dis J
2006; 25:801.
12Singhi P, Ray
M, Singhi S, Khandelwal N. Clinical spectrum of 500 children with neurocysticercosis
and response to albendazole therapy. J Child Neurol 2000; 15:207.
13Serpa JA,
Graviss EA, Kass JS, White AC Jr. Neurocysticercosis in Houston, Texas: an
update. Medicine (Baltimore) 2011; 90:81.
14Nash TE,
Garcia HH. Diagnosis and treatment of neurocysticercosis. Nat
Rev Neurol 2011; 7:584.
15del la Garza Y, Graviss EA, Daver NG, et al. Epidemiology of neurocysticercosis in Houston, Texas.
Am J Trop Med Hyg 2005; 73:766.
16Dixon HB,
Lipscomb FM. Cysticercosis: An analysis and follow-up of 450 cases, Her
Majesty's Stationary Service, London 1961.
17Montano SM, Villaran MV, Ylquimiche L, et al. Neurocysticercosis: association between seizures,
serology, and brain CT in rural Peru. Neurology 2005; 65:229.
18Fleury A,
Gomez T, Alvarez I, et al. High prevalence of calcified silent
neurocysticercosis in a rural village of Mexico. Neuroepidemiology 2003;
22:139.
19Prasad A,
Gupta RK, Pradhan S, et al. What triggers seizures in neurocysticercosis? A
MRI-based study in pig farming community from a district of North India. Parasitol
Int 2008; 57:166.
20Medina MT, Durón RM, Martínez L, et al. Prevalence, incidence, and etiology of epilepsies in
rural Honduras: the Salamá Study. Epilepsia 2005; 46:124.
21Garcia-Noval J, Moreno E, de Mata F, et al. An epidemiological study of epilepsy and epileptic
seizures in two rural Guatemalan communities. Ann Trop Med Parasitol 2001;
95:167.
22Nash TE, Singh
G, White AC, et al. Treatment of neurocysticercosis: current status and future
research needs. Neurology 2006; 67:1120.
23Del Brutto OH,
Santibañez R, Noboa CA, et al. Epilepsy due to neurocysticercosis: analysis of
203 patients. Neurology 1992; 42:389.
24Carpio A,
Hauser WA. Prognosis for seizure recurrence in patients with newly diagnosed
neurocysticercosis. Neurology 2002; 59:1730.
25Singh G, Singh
P, Singh I, et al. Epidemiologic classification of seizures associated with
neurocysticercosis: observations from a sample of seizure disorders in
neurologic care in India. Acta Neurol Scand 2006; 113:233.
26Rangel-Castilla L, Serpa JA, Gopinath SP, et al. Contemporary neurosurgical approaches to
neurocysticercosis. Am J Trop Med Hyg 2009; 80:373.
27Torres-Corzo
J, Rodriguez-della Vecchia R, Rangel-Castilla L. Bruns syndrome caused by
intraventricular neurocysticercosis treated using flexible endoscopy. J
Neurosurg 2006; 104:746.
28Viola GM,
White AC Jr, Serpa JA. Hemorrhagic cerebrovascular events and
neurocysticercosis: a case report and review of the literature. Am J Trop Med
Hyg 2011; 84:402.
29Callacondo D,
Garcia HH, Gonzales I, et al. High frequency of spinal involvement in patients
with basal subarachnoid neurocysticercosis. Neurology 2012; 78:1394.
30Barinagarrementeria
F, Cantú C. Frequency of cerebral arteritis in subarachnoid cysticercosis: an
angiographic study. Stroke 1998; 29:123.
31Jha S, Kumar
V. Neurocysticercosis presenting as stroke. Neurol India 2000; 48:391.
32Alsina GA,
Johnson JP, McBride DQ, et al. Spinal neurocysticercosis. Neurosurg Focus 2002;
12:e8.
33Bandres JC,
White AC Jr, Samo T, et al. Extraparenchymal neurocysticercosis: report of five
cases and review of management. Clin Infect Dis 1992; 15:799.
34Pushker N,
Bajaj MS, Chandra M. Ocular and orbital cysticercosis. Acta Ophthalmol Scand
2001; 79:408.
35Garcia HH, Del
Brutto OH, Cysticercosis Working Group in Peru. Neurocysticercosis: updated
concepts about an old disease. Lancet Neurol 2005; 4:653.
36Del Brutto OH,
Rajshekhar V, White AC Jr, et al. Proposed diagnostic criteria for
neurocysticercosis. Neurology 2001; 57:177.
37Rajshekhar V,
Chandy MJ. Validation of diagnostic criteria for solitary cerebral cysticercus
granuloma in patients presenting with seizures. Acta Neurol Scand 1997; 96:76.
38Sharma T,
Sinha S, Shah N, et al. Intraocular cysticercosis: clinical characteristics and
visual outcome after vitreoretinal surgery. Ophthalmology 2003; 110:996.
38Chang KH, Han
MH. MRI of CNS parasitic diseases. J Magn Reson Imaging 1998; 8:297.
39Zee CS, Go JL,
Kim PE, DiGiorgio CM. Imaging of neurocysticercosis. Neuroimaging Clin N Am
2000; 10:391.
40García HH, Del Brutto OH. Imaging findings in neurocysticercosis. Acta Trop
2003; 87:71.
41Castillo M.
Imaging of neurocysticercosis. Semin Roentgenol 2004; 39:465.
42Gupta RK,
Kumar R, Chawla S, Pradhan S. Demonstration of scolex within calcified
cysticercus cyst: its possible role in the pathogenesis of perilesional edema.
Epilepsia 2002; 43:1502.
43Garcia HH,
Harrison LJ, Parkhouse RM, et al. A specific antigen-detection ELISA for the
diagnosis of human neurocysticercosis. The Cysticercosis Working Group in Peru.
Trans R Soc Trop Med Hyg 1998; 92:411.
44Bustos JA, Garcia HH, Dorregaray R, et al. Detection of muscle calcifications by thigh CT scan in
neurocysticercosis patients. Trans R Soc Trop Med Hyg 2005;
99:775.
45Proaño-Narvaez JV, Meza-Lucas A, Mata-Ruiz O, et
al. Laboratory
diagnosis of human neurocysticercosis: double-blind comparison of enzyme-linked
immunosorbent assay and electroimmunotransfer blot assay. J Clin Microbiol
2002; 40:2115.
46Gekeler F,
Eichenlaub S, Mendoza EG, et al. Sensitivity and specificity of ELISA and
immunoblot for diagnosing neurocysticercosis. Eur J Clin Microbiol Infect Dis
2002; 21:227.
47Wilson M,
Bryan RT, Fried JA, et al. Clinical evaluation of the cysticercosis
enzyme-linked immunoelectrotransfer blot in patients with neurocysticercosis. J
Infect Dis 1991; 164:1007.
48Kojic EM,
White AC Jr. A positive enzyme-linked immunoelectrotransfer blot assay result
for a patient without evidence of cysticercosis. Clin Infect Dis 2003; 36:e7.
49Lee YM, Handali
S, Hancock K, et al. Serologic diagnosis of human Taenia solium cysticercosis
by using recombinant and synthetic antigens in QuickELISA™. Am J Trop Med Hyg
2011; 84:587.
50Garcia HH,
Gilman RH, Catacora M, et al. Serologic evolution of neurocysticercosis
patients after antiparasitic therapy. Cysticercosis Working Group in Peru. J
Infect Dis 1997; 175:486.
51Garcia HH,
Parkhouse RM, Gilman RH, et al. Serum antigen detection in the diagnosis,
treatment, and follow-up of neurocysticercosis patients. Trans R Soc Trop Med
Hyg 2000; 94:673.
52Garcia HH, Gonzalez AE, Gilman RH, et al. Circulating parasite antigen in patients with
hydrocephalus secondary to neurocysticercosis. Am J Trop Med Hyg 2002; 66:427.
53Fleury A,
Hernández M, Avila M, et al. Detection of HP10 antigen in serum for diagnosis
and follow-up of subarachnoidal and intraventricular human neurocysticercosis.
J Neurol Neurosurg Psychiatry 2007; 78:970.
54Rodriguez S, Dorny P, Tsang VC, et al. Detection of Taenia solium antigens and anti-T. solium
antibodies in paired serum and cerebrospinal fluid samples from patients with
intraparenchymal or extraparenchymal neurocysticercosis. J Infect Dis 2009;
199:1345.
55White AC Jr.
New developments in the management of neurocysticercosis. J Infect Dis 2009;
199:1261.
56Michelet L,
Fleury A, Sciutto E, et al. Human neurocysticercosis: comparison of different
diagnostic tests using cerebrospinal fluid. J Clin Microbiol 2011; 49:195.
57Wang CH, Gao
SF, Guo YP. Diagnostic significance of eosinophilia of the cerebrospinal fluid
in cerebral cysticercosis. Chin Med J (Engl) 1993; 106:282.
58Gutierrez Y.
Cysticercosis, Coenurosis, and Sparganosis. In: Diagnostic Pathology of
Parasitic Infection with Clinical Correlation, Gutierrez Y (Ed), Oxford
University Press, Oxford 2000. p.635.














En primer lugar saludarlo por la página web que Ud. administra, es de mucha utilidad.
ResponderEliminarRespecto al tema aportar, que el tratamiento antiparasitario debe administrarse en el paciente hospitalizado, porque se ha evidenciado que los primeros días de terapia cisticida los síntomas iniciales pueden agudizarse y por ende requiere un monitoreo permanente.
Saludos
Md. José Centeno A.
RII-Neurología - INCN-Perú
Muchas gracias José Centeno por tus palabras y por tu aporte.
ResponderEliminar